
| A. | 第二周期ⅣA族 | B. | 第三周期IA族 | C. | 第三周期ⅥA族 | D. | 第二周期ⅥA族 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg2Al2(OH)4(CO3)3 | B. | Mg3Al2(OH)6(CO3)2 | C. | Mg3Al(OH)3(CO3)3 | D. | Mg3Al2(OH)8(CO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
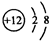 ;O的电子式为
;O的电子式为 ;H2S的结构式为H-S-H.
;H2S的结构式为H-S-H.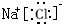 ,溶于水发生电离的电离方程式为NaCl=Na++Cl-,向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为Ag++Cl-=AgCl↓.
,溶于水发生电离的电离方程式为NaCl=Na++Cl-,向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为Ag++Cl-=AgCl↓.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若减小压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ | |
| C. | 反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L•min) | |
| D. | 当反应吸收热量为0.5QkJ时,生成的HCl通入1L 1mol/L的NaOH溶液恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氯气参加氧化还原反应时电子转移数一定是2NA | |
| B. | 常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA | |
| C. | 同温同压下,等质量的H2和O2的体积之比是16:1 | |
| D. | 0.1mol/L的MgCl2溶液中Cl-离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | CaCO3=CaO+CO2↑ | D. | Mg+2HCl=MgCl2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与S混合加热生成FeS2 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 铁与硝酸反应后溶液中一定有Fe3+存在 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、HCO3-、Cl- | B. | K+、Fe2+、Cl-、OH- | ||
| C. | Ag+、Al3+、NO3-、H+ | D. | Fe3+、Al3+、SCN-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com