
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
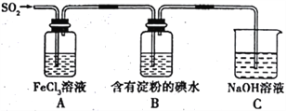
A. A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B. B装置中蓝色退去,说明还原性:SO2>I-
C. C装置中吸收尾气有可能倒吸
D. A、B装置中发生的反应转移电子数一定相等。
【答案】D
【解析】
A项,A装置中FeCl3溶液逐渐变为浅绿色,Fe3+被还原为Fe2+,说明SO2具有还原性;
B项,B装置中蓝色褪去,说明SO2与碘水发生了氧化还原反应,依据氧化还原反应中还原性:还原剂>还原产物分析;
C项,SO2能被NaOH溶液迅速吸收,导致C装置中导管内压强明显减小,C装置中可能产生倒吸;
D项,A、B装置中消耗反应物物质的量不确定。
A项,A装置中FeCl3溶液逐渐变为浅绿色,说明Fe3+被还原为Fe2+,则SO2被氧化,A装置中发生的反应为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,说明SO2具有还原性,A项正确;
B项,B装置中蓝色褪去,说明SO2与碘水发生了氧化还原反应,反应的离子方程式为SO2+I2+2H2O=4H++SO42-+2I-,在该反应中SO2为还原剂,I-为还原产物,氧化还原反应中还原性:还原剂>还原产物,则还原性:SO2>I-,B项正确;
C项,SO2污染大气,用NaOH溶液吸收尾气,SO2能被NaOH溶液迅速吸收,导致C装置中导管内压强明显减小,C装置中可能产生倒吸,C项正确;
D项,A、B装置中发生的离子反应依次为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+、SO2+I2+2H2O=4H++SO42-+2I-,由于A、B装置中消耗反应物物质的量不确定,A、B装置中反应转移电子物质的量不一定相等,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见的无毒物质。下列说法错误的是( )

A. 溶液中OH-向电极a移动
B. 电极b上发生还原反应
C. 负极的电极反应为2NH3-6e-+6OH-![]() N2+6H2O
N2+6H2O
D. 理论反应消耗的NH3与O2的物质的量之比为3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取X溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。

根据以上信息,回答下列问题:
(1)由强酸性条件即可判断X溶液中肯定不存在的离子有________________。
(2)溶液X中关于硝酸根离子的判断,正确的是______(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有
(3)气体F的电子式为____________,化合物I中含有的化学键类型有________________。
(4)转化①的离子方程式为_______________________________________________________。
转化⑦的离子方程式为_______________________________________________________。
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是________。
①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH试纸 ⑤KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院的科研人员在Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如下图。
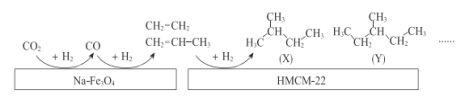
(1)Na-Fe3O4和HMCM-22 在反应中的作用为_______________
(2)(X)的系统命名的名称为_______________
(3)(Y)的一氯代物有_________________种
(4)(X)与(Y)的关系为 ________________
(5)在HMCM-22 表面生成摩尔质量为128g/mol且含两种氢的烷烃(Z),写出其结构简式___________,
(6)在HMCM-22 表面生成一种同温同压蒸气密度是氢气57倍且含有一种氢的烷烃(M),写出其与氯气反应生成一氯代烃的方程式______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈大齐高铁的通车,标志我国高寒地区高铁技术领先世界,车厢大部分采用铝合金材料制造,这是因为铝合金
A. 质量轻,强度大,抗腐蚀能力比较强 B. 具有比较活泼的化学性质
C. 各种成分在自然界中含量丰富,容易获取 D. 比纯铝熔点高,耐高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,请参照元素①~⑩在表中的位置回答下列问题.

(1)在这 10 种元素中,原子半径最大的是_________(填元素符号)。
(2)⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是______>_____(填化学式)。
(3)写出①、⑩元素组成比为2:1的化合物的电子式是_________。
(4)④⑤⑥⑦对应的离子半径最小的是_________(填离子符号)。
(5)写出实验室制取③的气态氢化物的化学方程式_________。
(6)⑦单质—空气燃料电池,以氢氧化钾溶液为电解质溶液,正极的反应式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中Y形管是一种特殊的仪器,通常与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。回答下列问题:

(1)广口瓶中间那根玻璃管的作用是:__________________________________________。
(2)实验前需要将BaCl2溶液煮沸,其目的是:_________________________________。
(3)甲中发生反应的化学方程式为:____________________________________________。
(4)乙中分别加入一种常用氧化物和一种无色液体,常温下将两者混合可产生一种碱性气体。该反应的化学方程式为:____________________________________________。
(5)实验时,先使甲中产生的足量气体通入BaCl2溶液中,始终无沉淀生成。由此得出的结论是_______。
(6)向上述⑸实验所得溶液中通入乙产生的气体,产生白色沉淀,请写出发生反应的离子方程式:_____。
(7) 请指出该实验的一个不足之处:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是

A. 在实验室中,可用浓氨水和生石灰制备氨气,用浓盐酸和浓硫酸制备氯化氢
B. 在实验室中制备干燥的氨气和氯化氢时,可选用相同的干燥剂
C. 实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D. 喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com