
氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2 + H2O H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。
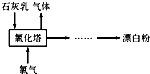
(2)工业上常用熟石灰和氯气反应制取漂白粉,化学反应方程式是 。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。

将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入。这样加料的目的是 。处理从氯化塔中逸出气体的方法是 。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是 ,其原因可能是 ,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生。
(1)[c(H+)·c(Cl-)·c(HClO)]/c(Cl2)
(2)2Ca(OH) 2+2Cl2=CaCl2+Ca(ClO)2+2H2O
充分接触(或充分吸收) 用碱液吸收(或石灰乳或碱石灰或氢氧化钠溶液等)
(3)6OH-+3Cl2=5Cl-+ ClO3-+3H2O 反应放热使温度升高所致
【解析】
试题分析:(2)熟石灰从塔顶喷洒从上向下,氯气从塔的最底层通入从下向上,氯气和熟石灰充分接触、混合,使其反应充分进行;氯气与碱反应,所以用碱液吸收;(3)氯化塔设计为四层是为了增大散热面积,防止反应过程产生的热量使体系温度升高,副反应增多。
考点:考查基本化学用语、工业流程中条件的控制等内容。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 氯气是重要的化工原料.
氯气是重要的化工原料.| C(H+)C(Cl-)C(HClO) |
| C(Cl2) |
| C(H+)C(Cl-)C(HClO) |
| C(Cl2) |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气是重要的化工原料.
氯气是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:
烧碱、氯气是重要的化工原料,产量很大。习惯上把电解饱和食盐水的工业叫做氯碱工业。根据你掌握的知识,完成下列问题:
(1)写出电解饱和食盐水的总化学反应方程式
(2)在该过程中阳极反应式为
阳极发生的是 反应(填“氧化”或“还原”)
请简要写出一种检验该产物的方法
(3)在实验室用惰性电极电解100mL的饱和食盐水,一段时间后,在阴极得到112mL气体(标准状况),此时电解质溶液的pH约为 (忽略电解液体积变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com