
| A、雾 |
| B、氢氧化铁胶体 |
| C、石灰乳 |
| D、KNO3溶液 |


科目:高中化学 来源: 题型:
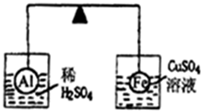 在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( )
在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( )| A、铝球一定是空心的 |
| B、左边烧杯中的溶液质量减少了 |
| C、去掉两烧杯杠杆仍平衡 |
| D、右边铁球上出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③④ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蔗糖溶液中加入几滴稀硫酸,水浴加热5min,加入NaOH溶液至碱性,再加入银氨溶液并水浴加热检验葡萄糖的生成 |
| B、苯中混有苯酚可与足量氢氧化钠溶液反应后分液除去 |
| C、使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素 |
| D、只用溴水一种试剂即可鉴别甲苯、己烯、乙醇、四氯化碳四种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 1mol/L MgCl2溶液 |
| B、200mL 0.25mol/L AlCl3溶液 |
| C、100ml 1mol/L NaCl溶液 |
| D、200ml 0.5mol/L HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 3 |
| 2 |
| T/K | 303 | 313 | 323:] |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com