
|
将60℃的硫酸饱和溶液100克,冷却到20℃,下列说法正确的是 | |
| [ ] | |
A. |
溶液质量不变 |
B. |
溶剂质量发生变化 |
C. |
溶液为饱和溶液,浓度不变 |
D. |
有晶体析出,溶剂质量不变 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
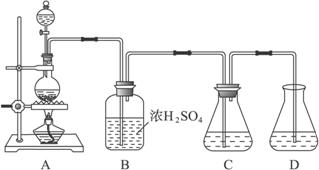
将
(1)如何配制60 mL浓H2SO4与10 mL水的混合液?
(2)装置B中浓H2SO4的作用:______________________________________________;
(3)Na2SO3溶液要分装在两个锥形瓶中的理由是__________________;写出C中发生反应的离子方程式__________________;
(4)控制SO2产生速度的方法是_____________________________________________;
(5)通SO2结束后,加Na2CO3的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

图1-5-11
将17 g Na2CO3溶于80 mL水中,分装在C、D中,再将25 g铜屑放入圆底烧瓶中,将60 mL浓硫酸和10 mL水的混合液装在分液漏斗中,逐滴加入硫酸后,小心加热使SO2逐渐产生(注意控制气量大小和反应速率的快慢)。将SO2通入Na2CO3溶液中至饱和,在合并C、D两瓶所得的溶液中,慢慢加入17 g Na2CO3,蒸发浓缩,冷却后得亚硫酸钠晶体。试完成:
(1)如何配制60 mL浓硫酸与10 mL水的混合液?
答:_________________________________________________________________。
(2)装置B中浓硫酸的作用:____________________________________________________
_____________________________________________________________________。
(3)Na2CO3溶液要分装在C、D两瓶中的理由是______________,发生反应的离子方程式为_____________________________________________________________________。
(4)控制SO2产生速率的方法是___________________________________________________
_____________________________________________________________________。
(5)通SO2结束后,加Na2CO3的目的是___________________________________________
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用碳酸钠制备少量亚硫酸钠晶体,有关装置如下图所示:

将17 g Na2CO3溶于80 mL水中,分装在C、D两个锥形瓶中,再将25 g铜屑放入圆底烧瓶中,将60 mL浓H2SO4和10 mL水的混合液装在分液漏斗中,逐滴加入硫酸后,小心加热使SO2逐渐产生(注意控制气量大小和反应速率的快慢)。将SO2通入Na2CO3溶液中至饱和,在合并C、D两瓶所得溶液中,慢慢加入17 g Na2CO3,蒸发浓缩,冷却后得亚硫酸钠晶体。试回答:
(1)如何配制60 mL浓H2SO4与10 mL水的混合液?
(2)装置B中浓H2SO4的作用:______________________________________________________;
(3)Na2SO3溶液要分装在两个锥形瓶中的理由是__________________;写出C中发生反应的离子方程式__________________;
(4)控制SO2产生速度的方法是_____________________________________________;
(5)通SO2结束后,加Na2CO3的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源:2010届靖江高级中学高三第三次模拟考试化学试题 题型:实验题
(10分) 二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂,常温下二氧化氯为黄绿色或橘黄色气体,易溶于水,易与碱液反应,其性质非常不稳定,温度过高、二氧化氯的水溶液质量分数高于30%等均有可能引起爆炸。某研究小组设计下图所示实验装置制备ClO2。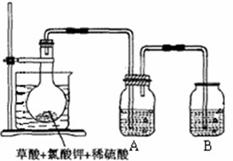
现称取12.25gKClO3和9g草酸(H2C2O4)放入烧瓶中,然后再加入足量的稀硫酸,水浴加热。
回答下列问题:
(1)已知反应后的产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为 。
(2)在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其保持在60℃~
80℃之间。这样操作的目的是 ,
图示装置中缺少的一种必须的玻璃仪器是 。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放 (填序号)。
a. 50mL 60℃的温水 b. 50mL冰水 c. 50mL饱和食盐水 d. 50mL NaOH溶液
(4)本实验所制得的二氧化氯水溶液质量分数约为 。(小数点后保留两位)
(5)二氧化氯可迅速氧化硫化物,以除去有机硫产生的臭味,改善水产养殖水体的水质。取适量二氧化氯溶液加入到硫化氢溶液中,再向其中加入少量氯化钡溶液,发现有白色沉淀生成。硫化氢溶液与二氧化氯发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com