

·ÖĪö £Ø1£©¢ŁĘ½ŗāŹ±·Å³öČČĮæĪŖ196kJ£¬ŌņĻūŗĵĶžŃõ»ÆĮņĪŖ$\frac{196kJ}{93kJ/mol}$=2mol£¬Ōņ£ŗ
SO2£Øg£©+$\frac{1}{2}$O2£Øg£©?SO3£Øg£©
ĘšŹ¼Įæ£Ømol£©£ŗ4 10 0
±ä»ÆĮæ£Ømol£©£ŗ2 1 2
Ę½ŗāĮæ£Ømol£©£ŗ2 9 2
ŌŁøł¾ŻK=$\frac{c£ØS{O}_{3}£©}{c£ØS{O}_{3}£©”Į\sqrt{c£Ø{O}_{2}£©}}$¼ĘĖćĘ½ŗā³£Źż£»
¢ŚA£®øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĪĀ¶ČŌ½µĶ£¬SO2µÄ×Ŗ»ÆĀŹŌ½“ó£»
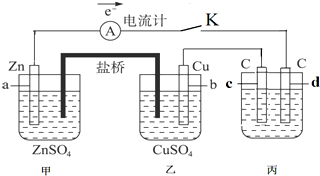
B£®ÓÉĶ¼æÉÖŖ£¬a”¢cĮ½µćŃ¹ĒæĻąĶ¬£¬Ę½ŗāŹ±aµćSO2×Ŗ»ÆĀŹøüøߣ¬øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĪĀ¶ČŌ½µĶ£¬SO2µÄ×Ŗ»ÆĀŹŌ½“󣬹ŹĪĀ¶ČT1£¼T3£¬ĪĀ¶ČŌ½øߣ¬·“Ó¦ĖŁĀŹŌ½æģ£»b”¢dĮ½µćĪĀ¶ČĻąĶ¬£¬Ń¹ĒæŌ½øߣ¬·“Ó¦ĖŁĀŹŌ½“ó£»
C£®ÓÉĶ¼æÉÖŖ£¬a”¢cĮ½µćŃ¹ĒæĻąĶ¬£¬Ę½ŗāŹ±aµćSO2×Ŗ»ÆĀŹøüøߣ¬øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬¹ŹĪĀ¶ČT1£¼T3£¬½µµĶĪĀ¶ČĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬KÖµŌö“ó£®Ę½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬b”¢dĮ½µćĪĀ¶ČĻąĶ¬£¬Ę½ŗā³£ŹżĻąĶ¬£»
D£®SO2×Ŗ»ÆĀŹµÄŌ½“ó£¬n×ÜŌ½Š”£¬½įŗĻM=$\frac{m}{n}$ÅŠ¶Ļ£»
¢ŪÓÉÓŚĪĀ¶Č²»±ä£¬¹ŹKÖµ²»±ä£¬ÓÖÓÉÓŚŃ¹Ēæ²»±ä£¬Ņņ“ĖĘųĢå·“Ó¦Ę½ŗā²»ŅĘ¶Æ£¬¼“Ź¹ŌŁĶØČėŅ»¶ØĮæSO3£Øg£©£¬SO2µÄĢå»ż·ÖŹżŅ²²»±ä£»
£Ø2£©¢ŁŃõĘų·¢Éś»¹Ō·“Ó¦£¬ĶØČėO2µÄµē¼«ŹĒÕż¼«£»
¢ŚSO2·¢ÉśŃõ»Æ·“Ó¦£¬Ź§Č„µē×Ó£¬Éś³ÉĮņĖįøłĄė×Ó£¬ÓɵēŗÉŹŲŗćæÉÖŖÓŠĒāĄė×ÓÉś³É£»
¢Ū×ó²ą²śÉśµÄ²æ·ÖĒāĄė×ÓĶعżÖŹ×Ó½»»»Ä¤ŅĘĻņÓŅ²ą£¬ÓŅ²ąŃõĘų»ńµĆµē×Ó£¬ĖįŠŌĢõ¼žĻĀÉś³ÉĖ®£¬Čō“Ė¹ż³ĢÖŠ×ŖŅĘĮĖ0.2molµē×Ó£¬ŌņĶعżÖŹ×Ó½»»»Ä¤µÄĒāĄė×ÓĪŖ0.2mol£¬øł¾Żµē×Ó×ŖŅĘŹŲŗć¼ĘĖć·“Ó¦µÄ¶žŃõ»ÆĮņ”¢ŃõĘųÖŹĮ棬ŌņÖŹ×ÓĤĮ½²ąµē½āŅŗµÄÖŹĮæ±ä»Æ²ī£ŗ”÷m×ó-”÷mÓŅ=m£ØSO2£©-m£ØH+£©-[m£ØO2£©+m£ØH+£©]£®
½ā“š ½ā£ŗ£Ø1£©¢ŁĘ½ŗāŹ±·Å³öČČĮæĪŖ196kJ£¬ŌņĻūŗĵĶžŃõ»ÆĮņĪŖ$\frac{196kJ}{93kJ/mol}$=2mol£¬Ōņ£ŗ
SO2£Øg£©+$\frac{1}{2}$O2£Øg£©?SO3£Øg£©
ĘšŹ¼Įæ£Ømol£©£ŗ4 10 0
±ä»ÆĮæ£Ømol£©£ŗ2 1 2
Ę½ŗāĮæ£Ømol£©£ŗ2 9 2
Ę½ŗā³£ŹżK=$\frac{c£ØS{O}_{3}£©}{c£ØS{O}_{3}£©”Į\sqrt{c£Ø{O}_{2}£©}}$=$\frac{\frac{2}{100}}{\frac{2}{100}”Į\sqrt{\frac{9}{100}}}$=$\frac{10}{3}$£¬¹Ź“š°øĪŖ£ŗ$\frac{10}{3}$£»
¢ŚA£®øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĪĀ¶ČŌ½µĶ£¬SO2µÄ×Ŗ»ÆĀŹŌ½“󣬹ŹĪĀ¶Č£ŗT3£¾T2£¾T1£¬¹ŹAÕżČ·£»
B£®ÓÉĶ¼æÉÖŖ£¬a”¢cĮ½µćŃ¹ĒæĻąĶ¬£¬Ę½ŗāŹ±aµćSO2×Ŗ»ÆĀŹøüøߣ¬øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĪĀ¶ČŌ½µĶ£¬SO2µÄ×Ŗ»ÆĀŹŌ½“󣬹ŹĪĀ¶ČT1£¼T3£¬ĪĀ¶ČŌ½øߣ¬·“Ó¦ĖŁĀŹŌ½æģ£¬Ōņv£Øc£©£¾v£Øa£©£»b”¢dĮ½µćĪĀ¶ČĻąĶ¬£¬Ń¹ĒæŌ½øߣ¬·“Ó¦ĖŁĀŹŌ½“󣬷“Ó¦·“Ó¦ĖŁĀŹ£ŗv£Øb£©£¾v£Ød£©£¬¹ŹBÕżČ·£»
C£®ÓÉĶ¼æÉÖŖ£¬a”¢cĮ½µćŃ¹ĒæĻąĶ¬£¬Ę½ŗāŹ±aµćSO2×Ŗ»ÆĀŹøüøߣ¬øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬¹ŹĪĀ¶ČT1£¼T3£¬½µµĶĪĀ¶ČĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬KÖµŌö“ó£¬ŌņĘ½ŗā³£Źż£ŗK£Øa£©£¾k£Øc£©£¬Ę½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬b”¢dĮ½µćĪĀ¶ČĻąĶ¬£¬Ę½ŗā³£ŹżĻąĶ¬£¬ŌņK£Øb£©=K£Ød£©£¬¹ŹCÕżČ·£»
D£®SO2×Ŗ»ÆĀŹµÄŌ½“ó£¬n×ÜŌ½Š”£¬»ģŗĻĘųĢå×ÜÖŹĮæ²»±ä£¬ÓÉM=$\frac{m}{n}$æÉÖŖĘ½¾łÄ¦¶ūÖŹĮæ£ŗM£Øa£©£¾M£Øc£©£¬M£Øb£©£¾M£Ød£©£¬¹ŹDÕżČ·£¬
¹ŹŃ”£ŗABCD£»
¢ŪÓÉÓŚĪĀ¶Č²»±ä£¬¹ŹKÖµ²»±ä£¬ÓÖÓÉÓŚŃ¹Ēæ²»±ä£¬Ņņ“ĖĘųĢå·“Ó¦Ę½ŗā²»ŅĘ¶Æ£¬¼“Ź¹ŌŁĶØČėŅ»¶ØĮæSO3£Øg£©£¬SO2µÄĢå»ż·ÖŹżŅ²²»±ä£¬¹Ź“š°øĪŖ£ŗ²»±ä£»
£Ø2£©¢ŁŃõĘų·¢Éś»¹Ō·“Ó¦£¬ĶØČėO2µÄµē¼«ŹĒÕż¼«£¬¹Ź“š°øĪŖ£ŗÕż£»
¢ŚSO2·¢ÉśŃõ»Æ·“Ó¦£¬Ź§Č„µē×Ó£¬Éś³ÉĮņĖįøłĄė×Ó£¬ÓɵēŗÉŹŲŗćæÉÖŖÓŠĒāĄė×ÓÉś³É£¬µē¼«·“Ó¦Ź½ĪŖ£ŗSO2-2e-+2H2O=SO42-+4H+£¬
¹Ź“š°øĪŖ£ŗSO2-2e-+2H2O=SO42-+4H+£»
¢Ū×ó²ą²śÉśµÄ²æ·ÖĒāĄė×ÓĶعżÖŹ×Ó½»»»Ä¤ŅĘĻņÓŅ²ą£¬ÓŅ²ąŃõĘų»ńµĆµē×Ó£¬ĖįŠŌĢõ¼žĻĀÉś³ÉĖ®£¬Čō“Ė¹ż³ĢÖŠ×ŖŅĘĮĖ0.2molµē×Ó£¬ŌņĶعżÖŹ×Ó½»»»Ä¤µÄĒāĄė×ÓĪŖ0.2mol£¬øł¾Żµē×Ó×ŖŅĘŹŲŗć£¬·“Ó¦µÄ¶žŃõ»ÆĮņĪŖ$\frac{0.2mol}{2}$=0.1mol£¬ÖŹĮæĪŖ0.1mol”Į64g/mol=6.4g£¬·“Ó¦µÄŃõĘųĪŖ$\frac{0.2mol}{4}$=0.05mol£¬ŃõĘųÖŹĮæĪŖ0.05mol”Į32g/mol=1.6g£¬ŌņÖŹ×ÓĤĮ½²ąµē½āŅŗµÄÖŹĮæ±ä»Æ²ī£ŗ”÷m×ó-”÷mÓŅ=m£ØSO2£©-m£ØH+£©-[m£ØO2£©+m£ØH+£©]=6.4g-1.6g-2”Į0.2mol”Į1g/mol=4.4g£¬
¹Ź“š°øĪŖ£ŗ4.4g£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗā¼ĘĖćÓėÓ°ĻģŅņĖŲ”¢Ę½ŗā³£Źż”¢Ōµē³ŲŌĄķ¼°¼ĘĖć£¬£Ø2£©ÖŠ¼ĘĖćĪŖŅדķµć”¢ÄŃµć£¬Ń§ÉśČŻŅ×ŗöĀŌÖŹ×ÓµÄŅĘ¶Æ£¬ÄŃ¶Č½Ļ“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ClO2×÷ĪŖĻū¶¾¼ĮŌŚĻū¶¾¹ż³ĢÖŠ¶ŌČĖĢåĪŽ¶¾ĪŽŗ¦£¬¾ßÓŠ¹ć·ŗµÄÓ¦ÓĆĒ°¾°£®Ä³Ķ¬Ń§ÓĆĻĀĶ¼ĖłŹ¾µÄ×°ÖĆÖʱøClO2ĘųĢ壬·“Ó¦ŌĄķĪŖ±„ŗĶ²ŻĖįČÜŅŗÓėKClO3·ŪÄ©ŌŚ60”ꏱ·“Ó¦ÖʵĆClO2£ØĪĀ¶Č¹żøß»ņ¹żµĶ¶¼»įÓ°ĻģÖĘĘųŠ§ĀŹ£©
ClO2×÷ĪŖĻū¶¾¼ĮŌŚĻū¶¾¹ż³ĢÖŠ¶ŌČĖĢåĪŽ¶¾ĪŽŗ¦£¬¾ßÓŠ¹ć·ŗµÄÓ¦ÓĆĒ°¾°£®Ä³Ķ¬Ń§ÓĆĻĀĶ¼ĖłŹ¾µÄ×°ÖĆÖʱøClO2ĘųĢ壬·“Ó¦ŌĄķĪŖ±„ŗĶ²ŻĖįČÜŅŗÓėKClO3·ŪÄ©ŌŚ60”ꏱ·“Ó¦ÖʵĆClO2£ØĪĀ¶Č¹żøß»ņ¹żµĶ¶¼»įÓ°ĻģÖĘĘųŠ§ĀŹ£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃ鱹ŗÅ | T£Ø”ę£© | n””£ØC£©/n | P£ØMPa£© |
| ¢ń | 150 | $\frac{1}{3}$ | 0.1 |
| ¢ņ | 150 | $\frac{1}{3}$ | 5 |
| ¢ó | 350 | $\frac{1}{3}$ | 5 |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | AlCl3 | B£® | CuCl2 | C£® | FeCl2 | D£® | HCl |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com