
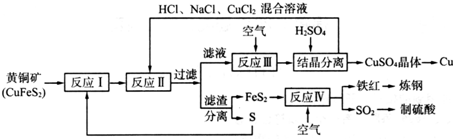
分析 (1)富铜矿砂与空气在高温下煅烧,使其转变为铜,反应产物有污染性气体二氧化硫生成;
(2)由流程可知,黄铁矿分解生成的Fe、Cu均为+2价;
(3)反应Ⅲ中生成铜离子;
(4)考虑产物的溶解度,溶解度小的先从溶液中析出;
(5)分析化合价变化,根据化合价的变化来判断和计算;
(6)①发生氧化还原反应生成硫酸亚铁;
②利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,可知,3SO2~Cr2O72-,以此计算.
解答 解:(1)富铜矿砂与空气在高温下煅烧,要消耗大量的热能,生成SO2会导致大气污染,故答案为:SO2会导致大气污染,同时要消耗大量的热能;
(2)由流程可知,黄铁矿分解生成的Fe、Cu均为+2价,则反应I的产物为FeS2、CuS,故答案为:FeS2、CuS;
(3)反应Ⅲ中生成铜离子,则离子反应为4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O,故答案为:4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O;
(4)相同条件下硫酸铜的溶解度小,则该温度下,硫酸铜的溶解度小于氯化铜,所以向反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,
故答案为:该温度下,硫酸铜的溶解度小于氯化铜;
(5)A.反应中被还原的除了O元素还有Cu元素,故A错误;B.二氧化硫为大气污染物,故B正确;C.从S元素化合价变化看,二氧化硫为氧化产物,从O元素化合价变化看,二氧化硫为还原产物,故C正确;D.8CuFeS2反应转移电子为8×2+21×4=100,故D正确,故选B、C、D;
(6)①发生氧化还原反应生成硫酸亚铁,离子反应为SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,故答案为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,
可知,3SO2~Cr2O72-,
3 1
x 0.02mol/L×0.025L
解得x=0.0015mol,
反应Ⅳ所得气体中SO2的体积分数为:$\frac{0.0015mol}{0.28L/22.4L/mol}$×100%=12.00%,
故答案为:12.00%.
点评 本题以实际化工生产“黄铜矿的综合利用”为背景,考查了元素化合物知识,离子方程式和化学方程式的书写及有关计算,题目更注重考查学生利用化学原理来解决实际问题的能力,利用关系式计算可简化计算.


科目:高中化学 来源: 题型:解答题

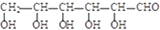 碱性条件下氧化为
碱性条件下氧化为 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广“低碳经济”,减少温室气体的排放 | |
| B. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | |
| D. | 关停化工企业,消除污染源头 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
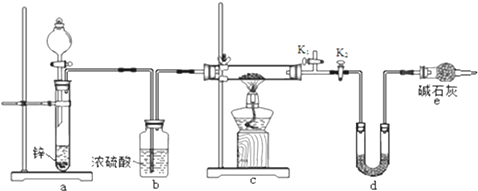
 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
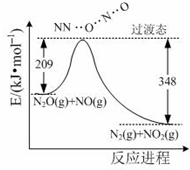 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
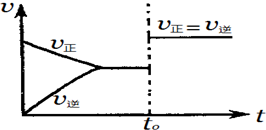
| A. | 若a+b=c,则t0时可能是增大反应体系的压强 | |
| B. | 若a+b=c,则t0时不可能是加入催化剂 | |
| C. | 若a+b≠c,则t0时只可能是加入催化剂 | |
| D. | 若a+b≠c,则t0时有可能是增大反应体系的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH均为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比 | |
| B. | (NH4)2SO4溶液中c(NH4+)与c(SO42-)之比 | |
| C. | 0.2mol/L的CH3COOH溶液与0.1mol/L和CH3COOH溶液中c(H+)之比 | |
| D. | 0.2mol/L的HCl与0.1mol/LHNO3溶液中n(H+)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此白色固体不可能是KHCO3和KOH的混合物 | |
| B. | 此白色固体中含有K2CO36.90g | |
| C. | 原KOH溶液的物质的量浓度是0.500 mol•L-1 | |
| D. | 此白色固体可能为KOH和K2CO3的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PCl3的水解产物是PH3和HCl | B. | CuCl2的水解产物是Cu(OH)2和HCl | ||
| C. | NaClO的水解产物是HClO和NaOH | D. | CaO2的水解产物是Ca(OH)2和H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com