
| n |
| V |
| 5.4g |
| 27g/mol |
| 0.2mol×2 |
| 2 |
| 0.2mol×3 |
| 2 |
| 0.2mol |
| 0.5L |


科目:高中化学 来源: 题型:
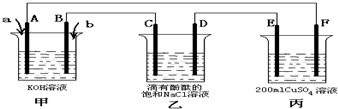
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:HCN>HClO |
| B、浓度:c(CN-)<c(ClO-) |
| C、pH:HClO>HCN |
| D、与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、Mg |
| B、Al、Si |
| C、Al、Mg |
| D、Al、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 反应达平衡时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| H2O,H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某物质中含有一种元素,则该物质一定是纯净物 |
| B、金刚石和石墨之间的转变一定是化学变化 |
| C、不同物质其相对分子质量一定不同 |
| D、不同的原子可相互组合成复杂的原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com