
(14分)某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母) 。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 | | | | | | |
序号 | A | B | C | D | E | F |
(3)下列情况会使所配溶液浓度偏低的是(填序号)
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
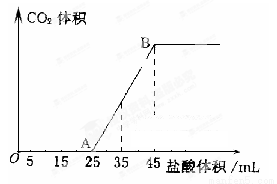
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为__________mL;
②计算所取氢氧化钠溶液的体积V=__________mL。
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为__________________________________,逐渐向反应后的溶液中至少加入1.0 mol L-1的盐酸________ mL才能使生成的沉淀完全溶解。
L-1的盐酸________ mL才能使生成的沉淀完全溶解。
(1)2.0 (2)A、B、E ;(3)①③⑤⑥ (4)224 450
(5)2Al+2NaOH+2H2O=2NaAlO2+3H2↑; 80
【解析】
试题分析:(1)若实验中大约要使用475mL0.10mol/L NaOH溶液,由于容量瓶的规格与之最相近的是500ml的容量瓶,所以应该配制500ml的溶液,则至少需要称量NaOH固体的质量是m(NaOH)= n·M=C·V·M =0.10mol/L×0.5L×40g/mol=2.0g;(2)称量NaOH固体所需要的仪器有天平、烧杯、药匙,因此代号是A、B、E;(3)①由于称量物品的原则是左物右码,所以称量时,左盘高,右盘低,说明药品的质量不足2.0g, 所以会使所配溶液浓度偏低,正确;②固体溶解后未冷却到室温就直接转移到容量瓶中,由于物质有热胀冷缩现象,所以当恢复至室温时,溶液的体积小于500ml,是溶液的浓度偏大,错误;③溶液转移到容量瓶后,未进行洗涤操作,则溶质的质量偏少,使所配溶液浓度偏低,正确;④转移溶液前容量瓶内有少量蒸馏水,不会产生影响,错误;⑤定容时,仰视容量瓶的刻度线,则溶液的体积就偏大,使溶液的浓度偏低,错误;⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制,则由于溶液的体积偏大,导致溶液的浓度偏低,正确。故选项是①③⑤⑥;(4)①在A~B段发生反应:NaHCO3+HCl=NaCl+H2O+ CO2↑,由于在HCl的体积是35ml时反应完成一半,所以产生的气体的体积是V(CO2)=n·Vm=1mol/L×0.01L×22.4L/mol =0.224 L=224ml; ②当气体达到最大值时溶液是NaCl溶液,根据原子守恒,可得n(NaOH)=n(NaCl) =n(HCl)= 1mol/L×0.045L=0.045mol,所以V(NaOH)=n÷C=0.045mol÷0.10mol/L=0.45L=450ml;(5)Al与NaOH反应的化学方程式为2Al+2NaOH +2H2O=2NaAlO2+3H2↑;逐渐向反应后的溶液中至少加入1.0 mol L-1的盐酸,首先发生反应:NaAlO2+ H2O+HCl=NaCl+ Al(OH)3↓,然后发生反应:Al(OH)3+3HCl= AlCl3 +3H2O,所以当沉淀完全溶解时总方程式是NaAlO2+ 4HCl=NaCl+ AlCl3 +2H2O,根据元素守恒可知n(NaAlO2)=n(NaOH)= 0.10mol/L×0.2 L=0.02mol,则n(HCl)=0.02mol×4=0.08mol,所以V(HCl)=0.08mol÷1.0 mol/L=0.08L=80ml。
L-1的盐酸,首先发生反应:NaAlO2+ H2O+HCl=NaCl+ Al(OH)3↓,然后发生反应:Al(OH)3+3HCl= AlCl3 +3H2O,所以当沉淀完全溶解时总方程式是NaAlO2+ 4HCl=NaCl+ AlCl3 +2H2O,根据元素守恒可知n(NaAlO2)=n(NaOH)= 0.10mol/L×0.2 L=0.02mol,则n(HCl)=0.02mol×4=0.08mol,所以V(HCl)=0.08mol÷1.0 mol/L=0.08L=80ml。
考点:考查物质的量浓度的溶液的配制、混合溶液中成分含量的测定、离子方程式的书写及有关计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届广东省东莞市高三第一次调研考试理科化学试卷(解析版) 题型:选择题
下述实验设计能够达到目的的是
选项 | 实验目的 | 实验设计 |
A | 证明Ksp(AgCl)﹥Ksp(AgI) | 往AgCl悬浊液中滴入KI浓溶液 |
B | 除去Cu粉中的CuO | 向混合物中滴加适量稀硝酸 |
C | 检验溶液中是否含有Fe2+ | 向溶液中滴入KSCN溶液,再滴加氯水 |
D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:实验题
6分)制备Cl2需用8 mol?L-1的盐酸100mL,现用12 mol?L-1的盐酸来配制。
①需要12 mol?L-1的盐酸的体积为 mL(精确到0.1 mL)
②为完成配制,除玻璃棒,小烧杯外,还需要选择的仪器为 。
A 100mL量筒 B托盘天平 C 100mL容量瓶 D.50mL容量瓶
E.10mL量筒 F.胶头滴管
③ 在容量瓶的使用方法中,下列操作中,不正确的是 (填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C. 配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近刻度线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:选择题
阿伏加德罗常数用NA表示,下列叙述正确的是
①标准状况下,22.4L乙醇中含有的氧原子数目为NA
②1L1 mol·L-1NH4Cl溶液中NH4+数目为NA
③0.44gC3H8中含有的共价键总数目为0.1NA
④25℃时,1LpH=13的Ba(OH)2溶液中含有OH-数目为0.2NA
⑤6.4g的S2和S8混合物中,含硫原子总数为0.2NA
⑥11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
A.③⑤ B.②⑤ C.③④ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:选择题
分类是化学学习与研究的常用方法,下列分类正确的是

A.Na2O、MgO、Al2O3均属于碱性氧化物
B.石灰石、生石灰、熟石灰均属于碱
C.酸、碱、盐之间发生的反应均属于复分解反应
D.混合物、分散系、胶体从属关系如图所示
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:选择题
对于4℃时100mL水中溶解了22.4 L HCl气体(标准状况下测得)后形成的溶液,下列说法中正确的是
A.该溶液物质的量浓度为10moL/L
B.所得的溶液的体积为22.5L
C.根据题干数据,该溶液物质的量浓度无法求得
D.该溶液中溶质的质量分数因溶液的密度未知而无法求得
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A. 亚硫酸钠溶液加入稀硝酸:SO32-+2H+= SO2↑+H2O
B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源:2015届山东省聊城市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其原子的电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )
A. Z与Y形成的化合物可作为耐高温材料
B.WY2能与碱反应,但不能与任何酸反应
C.原子半径按X、Y、Z、R、W的顺序依次增大
D.熔沸点:X2R>X2Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com