
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入
0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是( )
A.电解过程中阴极没有气体生成
B.电解过程中转移的电子的物质的量为0.4 mol
C.原CuSO4溶液的浓度为0.1 mol·L-1
D.电解过程中阳极收集到的气体体积为2.24 L(标况下)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
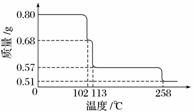
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式________________________________________
________________________________________________________________________;
(要求写出推断过程)。
(2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为________________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为________,其存在的最高温度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
使用氯化钠作原料可以得到多种产品。
(1)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的物质的量浓度是______________(忽略反应前后溶液体积的变化)。
(2)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。

对电源电极名称和消毒液的主要成分判断正确的是________(填字母序号)。
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
(3)实验室中很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。某同学利用上图装置,只更换一个电极,通过电解法制取较纯净的Fe(OH)2沉淀,且较长时间不变色。该同学换上的电解材料是__________(用元素符号表示),总的反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是________________。

(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________________________________________________________________________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)太阳能是清洁能源( )
(2)化石燃料和植物燃料燃烧时放出的能量均来源于太阳能( )
(3)农村用沼气池产生的沼气作燃料属于生物质能的利用( )
(4)人类利用的能源都是通过化学反应获得的( )
(5)随着科技的发展,氢气将成为主要能源之一( )
(6)食用植物体内的淀粉、蛋白质等属于直接利用能源( )
(7)粮食作物是制乙醇燃料的重要原料( )
(8)化石燃料属于可再生能源,不影响可持续发展( )
(9)开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量( )
(10)开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料( )
(11)低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com