
| A. | H2SO4的摩尔质量是98 | |
| B. | 等质量的O2和O3中所含的氧原子数相同 | |
| C. | 等体积的CO与CO2中所含碳原子数之比为1:1 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L |
分析 A、硫酸的摩尔质量为98g/mol;
B、O2和O3都是氧原子构成,所以氧原子的物质的量之比为1:1;
C、相同条件下等体积的CO与CO2中所含碳原子数之比为1:1;
D、将98gH2SO4溶解于500mL水中所得溶液体积并不是500ml,溶解的过程中体积要发生变化,应该是配制成500ml溶液;
解答 解:A、H2SO4的摩尔质量应该是98g/mol,故A错误;
B、O2和O3都是氧原子构成,所以氧原子的物质的量之比为1:1,所以等质量的O2和O3中所含的氧原子数相同,故B正确;
C、相同条件下等体积的CO与CO2中所含碳原子数之比为1:1,状况不知,无法求物质的量,故C错误;
D、将98gH2SO4溶解于水中配制成500mL溶液,所得溶液中硫酸的物质的量浓度为2mol/L,故D错误.
故选:B.
点评 本题考查了阿伏伽德罗常数的分析判断,物质的量浓度、摩尔质量、气体摩尔体积等几个概念分析应用,掌握基础是关键,题目较简单.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 纯锌粉 | 0.2 mol/L硫酸溶液 | 温度 | 硫酸铜固体 |
| Ⅰ | 2.0 g | 10.0 mL | 25℃ | 0 |
| Ⅱ | 2.0 g | 10.0 mL | t℃ | 0 |
| Ⅲ | 2.0 g | 10.0 mL | 35℃ | 0.2 g |
| Ⅳ | 2.0 g | 10.0 mL | 35℃ | 4.0 g |
| A. | 选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,必须控制t=25 | |
| B. | 待测物理量是收集等体积气体所需要的时间,时间越长,反应速率越大 | |
| C. | 根据该方案,可以探究浓度、温度、固体接触面积对反应速率的影响 | |
| D. | 根据该实验方案得出反应速率大小可能是Ⅲ>Ⅱ>Ⅰ>Ⅳ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(N2):c(H2)=1:3 | B. | 反应放出92.4 kJ的热量 | ||
| C. | v正(N2)=3v逆(H2) | D. | 容器内气体分子总数不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何分子或化合物都是通过原子间形成化学键相结合的 | |
| B. | 物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 分子的稳定性与化学键强弱有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ③⑤ | C. | ①②⑤ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| B. | 加水,平衡向逆反应方向移动 | |
| C. | 滴加少量0.1mol/LHCl溶液,溶液中C(H+ )减少 | |
| D. | 加入少量CH3 C OONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
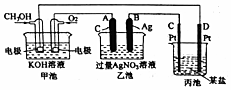
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com