
(9分)大理石与盐酸反应的反应速率如图所示,已知反应为放热反应。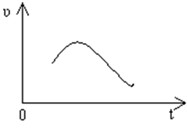
(1)写出该反应的离子反应方程式:
(2)反应开始时反应速率加快的原因是 。
(3)反应后期反应速率下降的原因是 。
科目:高中化学 来源: 题型:
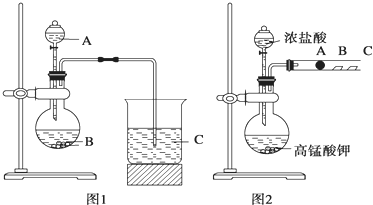
查看答案和解析>>
科目:高中化学 来源: 题型:

A.若温度相同,用①反应的盐酸浓度大于③反应,但H+物质的量相等
B.②反应时H+的物质的量浓度最大
C.②与①的反应速率相等
D.反应速率由大到小顺序为:①②③④
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
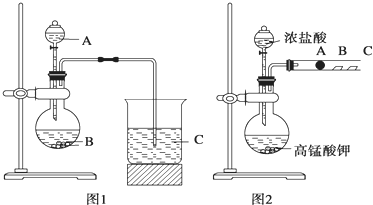
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省南充中学高一(下)期中化学试卷(理科)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com