
已知:①Fe2O3(s)+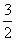 C(s)===
C(s)===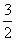 CO2(g)+2Fe(s);ΔH=234.1 kJ·mol-1 ②C(s)+O2(g)===CO2(g);ΔH=-393.5 kJ·mol-1,则2Fe(s)+
CO2(g)+2Fe(s);ΔH=234.1 kJ·mol-1 ②C(s)+O2(g)===CO2(g);ΔH=-393.5 kJ·mol-1,则2Fe(s)+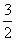 O2(g)===Fe2O3(s)的ΔH是( )
O2(g)===Fe2O3(s)的ΔH是( )
A.-824.4 kJ·mol-1 B.-627.6 kJ·mol-1
C.-744.7 kJ·mol-1 D.-169.4 kJ·mol-1
科目:高中化学 来源: 题型:
Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
A.Na2O2在反应中只作氧化剂
B.O2是还原产物
C.2molFeSO4发生反应时,反应中共有8mol电子转移
D.Na2FeO4既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,
其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z是三种短周期金属元素,原子序数依次增大,单质的物质的量分别为n(X)、n(Y)、n(Z),它们与足量盐酸反应产生的氢气体积(标准状况下)为V(H2)X、V(H2)Y、V(H2)Z,且n( X)=n(Y)=n(Z),2V(H2)X=V(H2)Y+V(H2)Z。下列说法正确的是( )
X)=n(Y)=n(Z),2V(H2)X=V(H2)Y+V(H2)Z。下列说法正确的是( )
A.X、Y、Z一定处于同一周期
B.X可能是镁
C.Y和Z的最高价氧化物对应的水化物在一定条件下能反应
D.工业上冶炼X、Y、Z通常是用热还原法制得
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列
问题:

(1)④、⑤、⑦的原子半径由大到小的顺序为________(用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>________。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态 化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式__________________________________________。
化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式__________________________________________。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
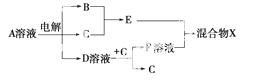
①写出D溶液与G反应的化学方程式_________________________________________
________________________________________________________________________。
②写出检验A溶液中溶质的阴离子的方法:_____________________________________
________________________________________________________________________。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为________mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状态下,气态分子断开l mol化学键的焓变称为键焓。已知H-H、H-O和O-O键的键焓ΔH分别为436 kJ/mol、463 kJ/mol和495kJ/mol。下列热化学方程式正确的是
A.H2O (g)= H2 (g)+
(g)+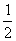 O2(g); ΔH= -485 kJ/mol
O2(g); ΔH= -485 kJ/mol
B.H2O (g)=H2(g)+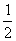 O2(g); ΔH==+485 kJ/mol
O2(g); ΔH==+485 kJ/mol
C.2H2(g)+ O2 (g)= 2H2O(g) ΔH = +485 kJ/mol
D.2H2(g)+ O 2(g)=2H2O(g) ΔH = -485 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+ 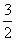 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=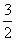 S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+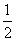 O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A.△H4=2/3(△H1+△H2-3△H3)
B.△H4=2/3(3△H3-△H1-△H2)
C.△H4=3/2(△H1+△H2-3△H3)
D.△H4=3/2(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
联 合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
(1)有效“减碳”的手段之一是节能。下列制氢方法最节能的是________(填字母序号)。
A.电解水制氢:2H2O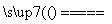 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O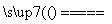 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O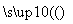 CO+3H2
CO+3H2
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)  CH3OH(g) ΔH=-90.7kJ·mol-1
CH3OH(g) ΔH=-90.7kJ·mol-1
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为_____ ______________________________
______________________________
______________________________________________________________________。
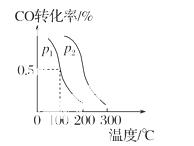
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成甲醇:CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1________p2(填“<”、“>”或“
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1________p2(填“<”、“>”或“ =”),上述反应的ΔH________0(填“<”、“>”或“=”)。
=”),上述反应的ΔH________0(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国科研人员以蹄叶橐吾为原料先制得化合物Ⅰ,再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示。下列有关说法不正确的是
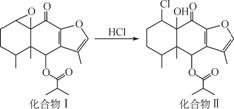
A.化合物Ⅰ能使酸性KMnO4溶液褪色
B.化合物Ⅰ分子中含有4个手性碳原子
C.化合物Ⅱ一定条件下能发生取代、消去及
加成反应
D.检验化合物Ⅱ是否含化合物Ⅰ可用Br2的
CCl4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com