
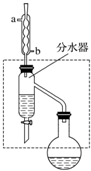
 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
分析 (1)冷凝管冷却时,采用逆流冷却时,温度差大,传热速度快,效果好;生成乙酸丁酯的反应为可逆反应,生成物有水,分离生成的水,使平衡正向移动,提高反应产率;
(2)①根据各物质的溶解性及性质进行排序;
②乙酸丁酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应而被吸收,硫酸与碳酸钠反应;
③根据乙酸异戊酯的密度及正确的分液操作方法进行解答;
(3)实验过程中收集124℃-126℃的馏分,称得质量为7.0g为实际得到乙酸正丁酯的质量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)冷凝管冷却时,采用逆流冷却的效果好,所以冷水从b进,生成乙酸丁酯的反应为可逆反应,生成物有水,分离生成的水,使平衡正向移动,提高反应产率,所以要通过分水器不断分离除去反应生成的水,
故答案为:b;分离生成的水,使平衡正向移动,提高反应产率;
(2)①因为正丁醇和乙酸都具有挥发性,所以制取的酯中含有正丁醇和乙酸,第一步水洗除去酯中的正丁醇和乙酸;第二步用10%碳酸钠洗涤除去乙酸;第三步用水洗涤除去碳酸钠溶液;第四步用无水硫酸镁干燥除去水;第五步蒸馏,制得较纯净的酯,
故选C;
②制备乙酸丁酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸丁酯的香味,溶解挥发出来的乙醇;降低乙酸丁酯在水中的溶解度,便于分层得到酯,
故答案为:除去产品中含有的乙酸、硫酸等杂质;
③由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d,
故选d;
(3)12.0mL正丁醇的质量为12.0mL×0.8g/mL=9.6g,设12.0mL正丁醇理论上生成酯物质的量为x,
根据反应CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
74g 116g 18g
9.6g xg
$\frac{74g}{9.6g}$=$\frac{116g}{x}$,
x=15.05g,当反应生成的水体积为1.8mL即为1.8g时,实际产量为11.6g,所以产率=$\frac{11.6g}{15.05g}$×100%=77.1%,
故答案为:77.1%.
点评 本题考查了乙酸正丁酯的制取方法,侧重考查了灵活运用基础知识解决实际问题的能力,有利于培养学生的实验能力,和严禁的逻辑思维能力,注意实验化学来源于常规实验和基本操作的综合应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 与28 gCO具有相同分子数的C2H4的质量一定是28 g | |
| B. | 1 molAl 3+含有的核外电子数为3NA | |
| C. | 常温常压下,1 mol甲烷含有的原子数为5NA | |
| D. | 常温常压下,1 molL氢气的体积大于22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | NH4HCO3受热易分解,可用作氮肥 | |
| C. | 氢氧化铝具有弱碱性,可用作净水剂 | |
| D. | 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
| A. | 4s时,c(B)为0.76 mol•L-1 | |
| B. | 830℃到平衡时,A的转化率为80% | |
| C. | 达平衡时,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,W 的体积分数减小,△H 增大 | |
| B. | 以 Y 的浓度变化表示的反应速率为 0.01 mol/(L•s) | |
| C. | 在其它条件不变的情况下,增加 1 mol X,则 X 和 Y 的转化率均提高 | |
| D. | 再向容器中通入 2 mol X 和 1 mol Y,达到平衡时,X、Y 的转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com