
分析 (1)镁离子与氢氧化钠反应生成氢氧化镁沉淀,所以检验的是氯化镁;碳酸钠与钙离子反应生成碳酸钙沉淀,加入碳酸钠是用于检验氯化钙;
(2)在溶解、蒸发、过滤操作中都会用到玻璃棒,在溶解样品时使用玻璃棒搅拌,以便加速溶解;蒸发滤液时用玻璃棒搅拌,使液体受热均匀;
(3)粗盐中含有氯化钙,需要加入碳酸钠溶液,反应生成碳酸钙沉淀,从而除去杂质钙离子;移入蒸发皿蒸发前,要除去多余的碳酸钠和氢氧化钠;
(4)根据存在步骤可知,A为碳酸钙沉淀,而B中含有反应生成的氯化钠.
解答 解:(1)氯化镁与氢氧化钠反应生成氢氧化镁沉淀,故加入氢氧化钠溶液的目的是检验溶液中是否含有MgCl2;
氯化钙与碳酸钠反应生成碳酸钙沉淀,则加入碳酸钠溶液的目的是检验溶液中是否含有CaCl2,
故答案为:MgCl2;CaCl2;
(2)②③⑤的步骤分别为溶解、过滤和蒸发操作,三种操作中都使用到玻璃棒,它在步骤②和⑤的操作方法都是搅拌,但目的不同,在步骤②的目的是加速固体的溶解,步骤⑤的目的是使液体受热均匀,避免液体飞溅,
故答案为:玻璃棒;加速溶解;使液体受热均匀,防止液体飞溅;
(3)已知粗盐溶液中含有氯化钙,即含有杂质钙离子,应该加入碳酸钠溶液除去,其反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;前面除杂质时加入过量的碳酸钠和氢氧化钠,移入蒸发皿蒸发前,要除去多余的碳酸钠和氢氧化钠,所以要加过量的稀盐酸;
故答案为:碳酸钠溶液;Na2CO3+CaCl2=CaCO3↓+2NaCl;加过量的稀盐酸;
(4)A为反应生成碳酸钙的质量,可以据此计算出氯化钙的质量,从而计算出氯化钠的质量分数;而B中含有新生成的氯化钠,无法计算氯化钠的质量分数,所以步骤⑥中需要称量的是A的质量,
故答案为:A; B中含有反应生成的氯化钠.
点评 本题考查了粗盐的提纯方法、性质实验方案的设计与评价,题目难度不大,注意掌握物质分离与提纯方法,正确理解提纯原理为解答本题的关键,试题有利于培养学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
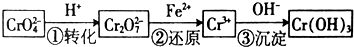
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | B. | 第一电离能:Na<Mg<Al | ||
| C. | 电负性:Na>Mg>Al | D. | 还原性:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒重操作是指加热、冷却、称量这一过程重复两次 | |
| B. | 加热时不断用玻璃棒搅拌 | |
| C. | 加热时晶体不小心溅出坩埚,再加一些胆矾 | |
| D. | 为了节约时间,加热时直接用大火加热直至最后 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应的反应速率变快,逆反应速率变慢,平衡向正反应方向移动 | |
| B. | 减小反应物浓度,逆反应的速率变慢,正反应速率变快,平衡向正反应方向移动 | |
| C. | 增大压强,正反应的反应速率加快,逆反应速率也加快,平衡向正反应方向移动 | |
| D. | 加入正催化剂,对正反应的反应速率影响更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应:3A+B?2C,在反应过程中C的物质的量分数随温度变化如图所示:
将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应:3A+B?2C,在反应过程中C的物质的量分数随温度变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C2H6 | C. | C2H2 | D. | C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打破温度计水银球,用硫粉处理洒落的水银 | |
| B. | 眼睛里不慎溅进了药液,应立即用水冲洗,并且用手使劲揉眼睛 | |
| C. | 少量浓硫酸沾到皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即逃离实验室 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com