
【题目】下列热化学方程式及其有关叙述正确的是( )
A.氢气的燃烧热为285.8kJ·mol-1,则水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH =+571.6kJ·mol-1
B.已知2C(石墨,s)+O2(g)=2CO(g) ΔH =+221kJ·mol-1,则石墨的燃烧热110.5kJ·mol-1
C.已知N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4kJ·mol-1,则在一定条件下将1mol N2和3mol H2置于一密闭容器中充分反应,放出92.4kJ的热量
2NH3(g) ΔH=-92.4kJ·mol-1,则在一定条件下将1mol N2和3mol H2置于一密闭容器中充分反应,放出92.4kJ的热量
D.已知乙炔的燃烧热为![]() ,则表示乙炔燃烧热的热化学方程式为
,则表示乙炔燃烧热的热化学方程式为![]() ΔH=
ΔH=![]()
【答案】A
【解析】
A、氢气的燃烧热为285.8kJmol-1,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,则水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH =+571.6kJ·mol-1,故A正确;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,已知2C(石墨,s)+O2(g)=2CO(g) △H=-221kJmol-1,CO不稳定,则石墨的燃烧热大于110.5kJmol-1,故B错误;
C、已知N2(g)+3H2(g) ![]() 2NH3(g)是可逆反应,不能完全反应,则在一定条件下将1molN2和3molH2置于一密闭容器中充分反应后,放出热量小于92.4kJ,故C错误;
2NH3(g)是可逆反应,不能完全反应,则在一定条件下将1molN2和3molH2置于一密闭容器中充分反应后,放出热量小于92.4kJ,故C错误;
D、乙炔的燃烧热为1299.6kJ/mol,则1molC2H2(g)完全燃烧生成液态水和二氧化碳放出1299.6kJ的热量,水的状态应为液态,故D错误。
故答案为A。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其分子式为C8H8O2,相对分子质量为 136,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环,且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中不正确的是( )
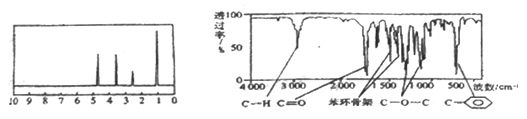
A. A分子属于酯类化合物,在一定条件下能发生水解反应
B. A在一定条件下可与3 mol H2发生加成反应
C. 符合题中A分子结构特征的有机物只有一种
D. 与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
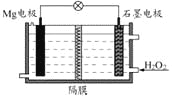
A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 | H2 | CO | H2O |
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙=丁>丙=甲B. 乙>丁>甲>丙
C. 丁>乙>丙=甲D. 丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是锂、氦、汞原子的吸收光谱和发射光谱。其中图______是原子由基态转化为激发态时的光谱,图______是原子由激发态转化为基态时的光谱。不同元素的原子光谱上的特征谱线不同,请在图中将同种元素原子的吸收光谱和发射光谱连接起来______。
①![]() ②
②![]()
③![]() ④
④![]()
⑤![]() ⑥
⑥![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42﹣(黄色)+ 2H+ → Cr2O72﹣(橙红色)+ H2O Ba2+ + CrO42﹣ → BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL,BaCl2溶液的浓度为_________________mol/L(含x、y的表达式),若步骤Ⅱ 中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将___________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.充电时阴极反应:Cd(OH)2+2e- = Cd+2OH-
B.充电过程阳极附近溶液的碱性增强
C.放电时电能转化为化学能
D.放电时电解质溶液中消耗1molH2O时电路中通过2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A.除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2=2Fe3++2Cl-
B.检验丙烯醛CH2=CHCHO中含有碳碳双键:CH2=CHCHO+Br2→CH2Br-CHBr-CHO
C.向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4+NH3·H2O+H2O
D.向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:Na2O2+4Fe2++6H2O=4Fe(OH)3+8Na++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的短周期部分
a | |||||||
b | c | d | |||||
e | f | g | h |
请参照元素a﹣h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有______ 种不同伸展方向的电子云,最外层共有______ 种不同运动状态的电子。
(2)比较d、e元素常见离子的半径大小(用化学式表示)______>______;b、c 两元素非金属性较强的是(写元素符号)______,写出证明这一结论的一个化学方程式______。
(3)d、e元素形成的四原子化合物的电子式为______;b、g元素形成的分子bg2为______分子(填写“极性”或“非极性”)。
(4)上述元素可组成盐R:ca4f(gd4)2,和盐S:ca4agd4,相同条件下,0.1mol/L 盐R中c(ca4+)______(填“等于”、“大于”或“小于”)0.1mol/L 盐S中c(ca4+)
(5)向盛有10mL1mol/L盐S溶液的烧杯中滴加1mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是______。
(6)向盛有10mL 1mol/L盐 R溶液的烧杯中滴加1mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL﹣35mL)间发生的离子方程式:______。若在10mL 1mol/L 盐R溶液的烧杯中加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com