
【题目】在一定条件下,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体的体积为原混合气体体积的![]() ,则原混合气体中NO2和O2的体积之比是
,则原混合气体中NO2和O2的体积之比是
A.8:1B.7:3C.1:7D.4:1
【答案】B
【解析】
NO2和O2的混合气体通入倒立于水槽中盛满水的试管中,发生反应可能为:4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO,剩余气体的体积为原混合气体的![]() ,试管中剩余
,试管中剩余![]() 体积的可能为NO或O2,结合反应方程式列式计算。
体积的可能为NO或O2,结合反应方程式列式计算。
发生反应为:4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO,剩余气体的体积为原混合气体的![]() ,则试管中剩余
,则试管中剩余![]() 体积的为NO或O2。设NO2和O2的总体积为V,
体积的为NO或O2。设NO2和O2的总体积为V,
当剩余气体为NO时,说明氧气不足,生成![]() V体积的NO消耗二氧化氮的体积为:
V体积的NO消耗二氧化氮的体积为:![]() V×3=
V×3=![]() ;
;
则反应4NO2+O2+2H2O=4HNO3中总共消耗二氧化氮和氧气的总体积为:![]() ,原混合气体中氧气的体积为:
,原混合气体中氧气的体积为:![]() ×
×![]() =
=![]() V,原混合气体中二氧化氮的体积为:
V,原混合气体中二氧化氮的体积为:![]() ,原混合气体中NO2和O2的体积比为:
,原混合气体中NO2和O2的体积比为:![]() :
:![]() V=7:1;
V=7:1;
当氧气过量时,剩余的![]() V体积为O2,说明NO2不足量,则参加反应4NO2+O2+2H2O=4HNO3中总共消耗NO2和O2的总体积为
V体积为O2,说明NO2不足量,则参加反应4NO2+O2+2H2O=4HNO3中总共消耗NO2和O2的总体积为![]() ,混合气体中二氧化氮的总体积为:
,混合气体中二氧化氮的总体积为:![]() ×
×![]() =
=![]() ,O2总体积为
,O2总体积为![]() ,故原气体中NO2和O2的体积比为
,故原气体中NO2和O2的体积比为![]() :
:![]() =7:3,
=7:3,
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】聚合碱式氯化铁[![]() (m为聚合度)为无机高分子絮凝剂,广泛应用于水处理。以铁矿石、氧化铁皮或
(m为聚合度)为无机高分子絮凝剂,广泛应用于水处理。以铁矿石、氧化铁皮或![]() 为原料,在酸性条件下经氧化、水解、聚合、熟化等步骤,可制得聚合碱式氯化铁。
为原料,在酸性条件下经氧化、水解、聚合、熟化等步骤,可制得聚合碱式氯化铁。
(1)钢铁酸洗废液中主要含有![]() 和
和![]() ,通入空气可制得
,通入空气可制得![]() ,反应的化学方程式________。氧化剂
,反应的化学方程式________。氧化剂![]() 也可以将
也可以将![]() 氧化成
氧化成![]() ,但存在的缺点是________________。
,但存在的缺点是________________。
(2)“氧化”过程中,若盐酸的浓度或投入量增大,除了会降低![]() 的转化率,还可能产生的影响为________________。
的转化率,还可能产生的影响为________________。
(3)①准确称取聚合碱式氯化铁样品1.5000g,置于250mL的锥形瓶中,加入适量稀盐酸,加热,迅速加入稍过量的![]() 溶液(
溶液(![]() 被
被![]() 氧化成为
氧化成为![]() ),充分反应后,多余的
),充分反应后,多余的![]() 用
用![]() 氧化除去。再加入适量的
氧化除去。再加入适量的![]() 组成的混酸及4~5滴指示剂,用
组成的混酸及4~5滴指示剂,用![]() 溶液滴定至终点(滴定过程中
溶液滴定至终点(滴定过程中![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() ),消耗
),消耗![]() 溶液
溶液![]() 。
。
②另称取等质量的聚合碱式氯化铁样品溶于水中,配成500mL溶液,取25mL溶液于锥形瓶中,用铬酸钾(![]() )溶液作指示剂,用
)溶液作指示剂,用![]() 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗![]() 溶液8.10mL。
溶液8.10mL。
计算该样品中氯元素和铁元素的质量分数之比![]() 为________(写出计算过程,结果保留四位有效数字)。
为________(写出计算过程,结果保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1
②C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=-Q3 kJ·mol-1
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)
A. Q1+Q2+Q3B. 1.5Q1-0.5Q2+0.5Q3
C. 0.5Q1-1.5Q2+0.5Q3D. 0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
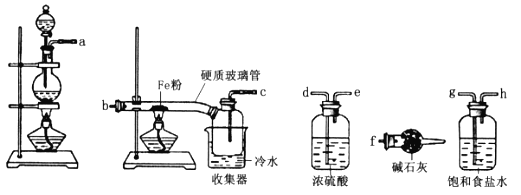
(1)装置的连接顺序为a→_____→______→_____→_____→b→c→f。________
(2)硬质玻璃管与收集器之间没有用导管连接,这样做的优点是________________。
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
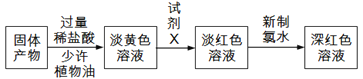
试剂X中溶质的化学式为____________;固体产物的成分可能为_____(填字母)。
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是____________,加入新制氯水后溶液红色加深的原因:___________(用离子方程式表示)。
(5)现有一含FeCl2和FeCl3混合物的样品,用离子交换法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为______。(计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列与溶液pH有关的计算
(1)室温下pH=2的HCl溶液和pH=10的NaOH溶液中由水电离出的c(H+)之比为____。
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为__。
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液pH=3,则a:b=___。
(4)已知某温度时0.1molL-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是___(用含a、b的表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
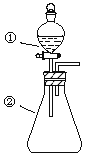
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 新制氯水 | 淀粉碘化钾溶液 | 溶液变蓝色 |
D | 浓盐酸 | MnO2 | 产生黄绿色气体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.物质A的转化率提高了B.平衡向逆反应方向移动了
C.物质B的质量分数减少了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾晶体化学式为:KxFey(CN)znH2O,俗称黄血盐,常用作食品抗结剂。一种用NaCN(N显-3价)废液制取黄血盐的主要工艺流程:
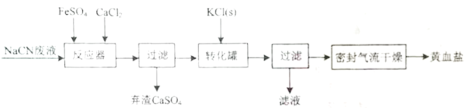
(1)实验室用绿矾固体配制FeSO4溶液时,应先________,再用蒸馏水稀释。
(2)“转化罐”中生成黄血盐晶体的反应类型为________。
(3)采用密封气流干燥取代在通风橱内干燥的原因是________。
(4)黄血盐的化学式可通过下列实验测定:
①准确称取4.220g样品加入水中充分溶解,将所得溶液转移至容量瓶配制成100.00mL溶液A。
②量取25.00mL溶液A,用2.000molL-1KMnO4溶液滴定,达到滴定终点时,共消耗KMnO4溶液15.25mL。反应如下(未配平):![]() ③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
通过计算确定样品的化学式(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2 + 6NaOH ![]() 5NaCl + NaClO3 + 3H2O,以下叙述正确的是( )
5NaCl + NaClO3 + 3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的Cl原子与被还原的Cl原子的个数比为1∶5
C.氧化产物与还原产物的物质的量的比为5∶1
D.每生成1mol的NaClO3转移6mol的电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com