
| A. | -48.5kJ/mol | B. | +48.5kJ/mol | C. | -45.5kJ/mol | D. | +45.5kJ/mol |
分析 由①2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-23.9kJ/mol
②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ/mol
③CH3CH2OH(g)═CH3OCH3(g)△H3=+50.7kJ/mol
结合盖斯定律可知,①-②-③得到C2H4(g)+H2O(g)=CH3CH2OH(g)
解答 解:由①2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-23.9kJ/mol
②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ/mol
③CH3CH2OH(g)═CH3OCH3(g)△H3=+50.7kJ/mol,
由盖斯定律①-②-③得到C2H4(g)+H2O(g)=C2H5OH(g)△H4=(-23.9KJ/mol)-(-29.1KJ/mol)-(+50.7kJ/mol)=-45.5 kJ•mol-1,
故选C.
点评 本题考查反应热与焓变,为高频考点,把握已知反应与目标反应的关系、焓变的关系为解答的关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
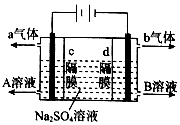 利用三室式电解池(装置结构如图所示,电极均为惰性电极)可以实现用硫酸钠溶液制取硫酸和氢氧化钠.下列叙述正确的是( )
利用三室式电解池(装置结构如图所示,电极均为惰性电极)可以实现用硫酸钠溶液制取硫酸和氢氧化钠.下列叙述正确的是( )| A. | a气体为氢气,b气体为氧气 | |
| B. | A为氢氧化钠溶液,B为硫酸溶液 | |
| C. | 通电后中间隔室的SO42-向阴极移动,阳极区溶液的pH增大 | |
| D. | 该电解反应的方程式为2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、Cl-、NO3- | B. | K+、Na+、OH-、CO32- | ||
| C. | Na+、Mg2+、Cl-、SO42- | D. | OH-、NO3-、Fe2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{m+A}$(A-N+m)mol | B. | a/N(A-N)mol | C. | a/A(A-N+m)mol | D. | a/A(A-N-m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol | B. | 0.2 mol | C. | 0.3 mol | D. | 0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨形成的主要原因是大量石油、煤等矿物燃料的燃烧 | |
| B. | 反应物的总能量高于生成物的总能量时,反应放热 | |
| C. | 原电池是化学能转变为电能的一种装置 | |
| D. | 在铜、锌和稀硫酸构成的原电池中,铜是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2、Fe3O4、CuO均为碱性氧化物 | B. | 盐酸、水玻璃、氨水均为混合物 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 稀豆浆、硅酸、氯化铁溶液均为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30gSiO2晶体中含有NA个硅氧键 | |
| B. | 常温常压下,11.2LCl2含有的分子数目少于0.5NA | |
| C. | 25℃时,pH=12的NaOH溶液含有的OH-数目为0.01NA | |
| D. | 50mL18.4mol/L浓硫酸与足量铜微热,生成SO2分子的数目为0.46NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com