
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是

A. 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前υ(正)>υ(逆)
B. 200℃时,反应从开始到刚好达平衡的平均速率υ(B)=0.02 mol·L﹣1·min﹣1
C. 图Ⅱ所知反应xA(g)+yB(g) ![]() zC(g)的△H<0
zC(g)的△H<0
D. 200℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数大于0.5
【答案】B
【解析】
A.恒温恒容条件下,通入氦气,各物质的浓度不变,平衡不移动,故υ(正)=υ(逆),故A 错误;
B.由图Ⅰ可以知道,![]() 时
时![]() 达到平衡,平衡时B的物质的量变化量为0.4mol-0.2mol=0.2mol,故υ(B)=0.02
达到平衡,平衡时B的物质的量变化量为0.4mol-0.2mol=0.2mol,故υ(B)=0.02![]() ,故B正确;
,故B正确;
C.由图Ⅱ可以知道,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应方向移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即![]() H
H![]() 0,故C错误;
0,故C错误;
D.由图Ⅰ可以知道,![]() 时平衡时,A、B、C的物质的量变化量分别为
时平衡时,A、B、C的物质的量变化量分别为![]() 、
、![]() 、
、![]() ,物质的量之比等于化学计量数之比,故x:y:z=0.4mol:0.2mol:0.2mol=2:1:1,反应的化学方程式为2A(g)+B(g)C(g),平衡时A的体积分数为
,物质的量之比等于化学计量数之比,故x:y:z=0.4mol:0.2mol:0.2mol=2:1:1,反应的化学方程式为2A(g)+B(g)C(g),平衡时A的体积分数为![]() ,
,![]() 时,向容器中充入2molA和1molB达到平衡等效为原平衡增大压强,平衡向正反应移动,故达到平衡时A的体积分数小于0.5,故D错误;
时,向容器中充入2molA和1molB达到平衡等效为原平衡增大压强,平衡向正反应移动,故达到平衡时A的体积分数小于0.5,故D错误;
本题答案为B。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:
【题目】HIn在水溶液中存在以下电离平衡:HIn(红色)![]() H+ + In-(黄色),故可用作酸碱指示剂。浓度为0.02 mol/L的下列各溶液:①盐酸,②石灰水,③NaCl溶液,④NaHSO4溶液,⑤Na2CO3溶液,⑥氨水,其中能使指示剂显红色的是
H+ + In-(黄色),故可用作酸碱指示剂。浓度为0.02 mol/L的下列各溶液:①盐酸,②石灰水,③NaCl溶液,④NaHSO4溶液,⑤Na2CO3溶液,⑥氨水,其中能使指示剂显红色的是
A. ①④⑤ B. ②⑤⑥ C. ①④ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。

已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:
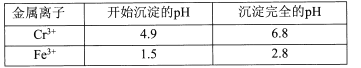
回答下列问题:
(l)滤渣②的主要成分为____(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式____。
(3)“加热”操作的目的是____。
(4)“酸化”过程中发生反应2CrO42-+2H+![]() Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-l (NH4)2Fe(SO4)2 标准溶液滴定,滴定终点消耗标准溶液的体积为9.00 mL,则产品的纯度为____。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如下图所示。

①负极的电极反应式为____;
②一段时间后,中间室中NaCl溶液的浓度____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列与“物质的量”相关的计算。
(1)标准状况下,33.6LCO2的物质的量为___mol,质量为___g,所含O原子的数目是____个。
(2)同温同压下,同体积的氨(NH3)和硫化氢(H2S)气体的质量之比是____,同质量的氨和硫化氢气体所含氢原子个数之比是___。
(3)agCl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为________________。
②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示:

图1
实验过程中应将温度控制在________________。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为________________。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是________________。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图2所示。A包含物质的化学式为N2和________________。


图2 图3
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为________________。
②C点高于B点的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,50mL 0.10mol/L的醋酸中存在着如下平衡:CH3COOH ![]() CH3COO―+H+。若分别作如下改变,对上述平衡有何影响
CH3COO―+H+。若分别作如下改变,对上述平衡有何影响
(1)加入少量冰醋酸,平衡将_______________________,溶液中c(H+)将________________;
(2)加入一定量蒸馏水,平衡将__________________,溶液中c(H+)将__________;
(3)加入少量0.10mol/L盐酸,平衡将________________,溶液中c(H+)将_________________;
(4)加入20 mL 0.10mol/L的NaOH溶液,平衡将__________________,溶液中c(H+)将__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400 ℃时,将一定量的SO2和 14 mol O2压入一个盛有催化剂的10 L密闭容器中进行反应:2SO2+O2 ![]() 2SO3
2SO3
已知 2 min后,容器中剩余 2 mol SO2和12 mol O2。试计算:
(1)生成SO3的物质的量。______
(2)SO2的起始物质的量浓度。______
(3)2 min 内SO2和SO3的反应速率。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向碳酸钠溶液中加入足量的盐酸:CO32-+2H+=CO2↑+H2O
B.氢氧化钡溶液中加入足量稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++H2O![]() Fe(OH)3↓+H+
Fe(OH)3↓+H+
D.澄清石灰水中加盐酸:Ca(OH)2 +2H+ = Ca2+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展新能源汽车是国家战略,经过近10年的发展,目前我国新能源汽车产销量均达到80万辆,LiFePO4电池是新能源汽车关键部件之一,其工作原理如图所示。下列说法错误的是( )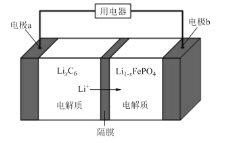
A. 充电时,电极a与电源的负极连接,电极b与电源正极连接
B. 电池驱动汽车前进时,正极的电极反应为:Li1-xFePO4+x Li++x e-= LiFePO4
C. 电池驱动汽车后退时,负极材料减重1.4g ,转移0.4mol电子
D. 电池进水将会大大降低其使用寿命
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com