
���� ��1������ˮ��Ӳ�����ɸƺ�þ�������λ��Ȼ��������ģ�����Ӳ�Ƚ�������Ӳ�ȣ����ݳ���ʱ���������µ����ʣ�
��2���ٸ���Ca��HCO3��2��Mg��HCO3��2�����ʷ���ˮ���γɵĹ��̡�д��ˮ���γɵĹ��̵Ļ�ѧ����ʽ��
�ڷ�Ӧ���ɵĶ�����̼������ˮ��Ҫ���ȳ�ȥ��
��EDTA����Һ��Ũ�Ⱥ����ĵ����������������ӵ����ʵ���������������Ƶ�������ˮ��Ӳ�ȣ�
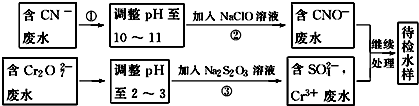
��3���ټ��������£�CN-������NaClO����������ԭ��Ӧ����CNO-��Cl-���ӣ��ݴ�д�����ӷ���ʽ��
��Cr3+��ˮ�ж�����ʹCr3+���ɳ������˳�ȥ��
��� �⣺��1����ˮ��Ӳ�����ɸƺ�þ�������λ��Ȼ��������ģ�����Ӳ�Ƚ�������Ӳ�ȣ���֪ˮ����Ҫ��Ca2+��Mg2+��Cl-��SO42-�����Ӳˮ��Ӳ����������Ӳ�ȣ������ʱ���������µ����ʣ������ĸ�����ͨ����������ȥ�����ȼ�ʯ�ң���Ӵ��
�ʴ�Ϊ�����ã� ʯ�ң����
��2����������Ȼ���ˮ�д�����һ������Mg��HCO3��2��������ʱ����Mg��OH��2�����ְ�ɫ�����������ڱ��ϻ��������γ�ˮ��������ˮ���γɵĹ��̵ķ���ʽΪMg��HCO3��2=Mg��OH��2��+2CO2�����ʴ�Ϊ��Mg��HCO3��2=Mg��OH��2��+2CO2����
��Ԥ�����ķ�������ˮ���м���Ũ���ᣬ������Mg��HCO3��2��Ӧ���ɶ�����̼��CO2������ˮ������Ҫ������г�ȥ���ʴ�Ϊ����ȥ�ܽ��CO2��
�۸�����֪��Ӧ��֪�ζ�ǰ��ҺΪ�ƺ�ɫ���ζ�������Ϊ��ɫ��������Һ��ɫ�仯Ϊ�ƺ�ɫ��Ϊ��ɫ��
��0.01000mol•L-1��EDTA����Һ���еζ����ζ��յ�ʱ������EDTA��Һ15.00mL����n��M2+��=n��EDTA��=0.01000mol•L-1��15.00��10-3=1.5��10-4mol��
��25mlˮ��m��CaO��=nM=56g/mol��1.5��10-4mol=8.2mg������1Lˮ��m��CaO��=8.2mg��1000��25=336mg��ͨ����1Lˮ�к���10mg CaO��Ϊ1�ȣ����Ըõ���ˮ��Ӳ��Ϊ336mL��10mL=33.6�ȣ�
�ʴ�Ϊ��33.6�ȣ�
��3���ٲ�����У�������ų���CN-��ClO-����ΪCNO-������Ϊ���ڼ��Ի����У���ClO-ֻ�ܱ���ԭΪCl-����ӦʽΪ��CN-+ClO-�TCNO-+Cl-��
�ʴ�Ϊ��CN-+ClO-�TCNO-+Cl-��
��Cr3+��ˮ�ж�����ʹCr3+���ɳ������˳�ȥ���ʵ��ڷ�ˮpH��ʹ��ת����Cr��OH��3������ȥ���ʴ�Ϊ�����ڷ�ˮpH��ʹ��ת����Cr��OH��3������ȥ��
���� ������һ����ѧ���������ϵ���Ŀ��ע��֪ʶ��Ǩ��Ӧ�ã��ѶȲ����ܽϺõĿ���ѧ�������ͽ�������������


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����� | �� | �� | �� | �� |
| ̼���g�� | 6.2 | 9.3 | 15.5 | 21.7 |
| ˮ��mL�� | 18 | 18 | 18 | 18 |
| ���壨L����״���� | 3.36 | 5.04 | 8.4���� | 8.4���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 B��
B�� C��
C�� D��
D��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ԣ�NaOH��Mg��OH��2 | B�� | ���ȶ��ԣ�Na2CO3��NaHCO3 | ||
| C�� | �����ԣ�Na��Mg | D�� | ˮ���ܽ��ԣ�Mg��OH��2��Na2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
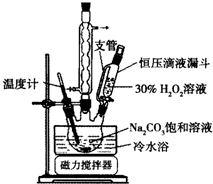 2Na2CO3•3H2O2��һ�����͵���ϵƯ����ijʵ����ȤС�����������ʵ�飮
2Na2CO3•3H2O2��һ�����͵���ϵƯ����ijʵ����ȤС�����������ʵ�飮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
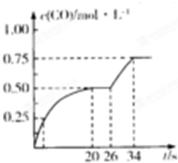 ���顢�״���CO��H2��CO2������Ҫ�Ļ���ԭ�ϣ�
���顢�״���CO��H2��CO2������Ҫ�Ļ���ԭ�ϣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | MgCl2 | Mg��OH��2 | MgCO3 |
| �ܽ�ȣ�g/100g�� | 74 | 0.00084 | 0.01 |
| A�� | ��֪MgCO3��KSp=6.82��10-6mol2•L-2�������к��й���MgCO3����Һ�У�����c��Mg2+��=c��CO32-������c��Mg2+��•c��CO32-��=6.82��10-6mol2•L-2 | |
| B�� | ��ȥ�����к��е�MgCl2���ʣ���ѳ����Լ�ΪNa2CO3��Һ | |
| C�� | �������������ʷֱ���ˮ��ϣ��ֱ���ȡ����գ����յĹ��������ͬ | |
| D�� | ������ʯ��ˮ��������Mg2+��HCO3-��Ӳˮ�����������ӷ�Ӧ����ʽΪMg2++2HCO3-+Ca2++2OH-=CaCO3��+MgCO3��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ����������ˮ���ƾ���ˮ��ֲ���ͺ�ˮ | |
| B�� | ���Ȼ�̼��ˮ���屽��ˮ����������ˮ | |
| C�� | ���ͺ�ˮ��������Ҵ��������ˮ | |
| D�� | ˮ��ֲ���͡������ˮ������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
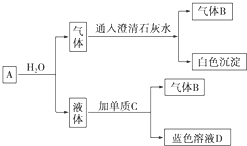
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com