(2011?太原二模)[化学--选物质结构与性质]
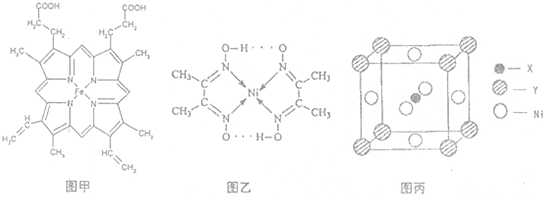
(1)如图甲,血红素含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是
H<C<N<O
H<C<N<O
,根据以上电负性请判断H
2N-CHO中C和N的化合价分别为
+2
+2
和
-3
-3
.基态Fe原子的核外电子排布式为
1s22s22p63s23p63d64s2或[Ar]3d64s2
1s22s22p63s23p63d64s2或[Ar]3d64s2
.血红素中两种N原子的杂化方式分别为
sp2
sp2
、
sp3
sp3
.
(2)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.Cl
2、IBr、ICl沸点由高到低的顺序为
BrI>ICl>Cl2
BrI>ICl>Cl2
.I
+3(可看成II
+2)属于多卤素阳离子,根据VSEPR模型推测I
+3的空间构型为
V形
V形
.多卤化物RbICl
2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,则A的化学式为
RbCl
RbCl
.
①HClO
4、②HIO
4、③HIO
6[可写成(HO)
5IO]的酸性由强到弱的顺序为
①②③
①②③
(填序号).
(3)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.配合物Ni(CO)
4常温为流态,易溶于CCl
4、苯等有机溶剂,固态Ni(CO)
4属于
分子
分子
晶体.如图乙配合物分子内的作用力除共价键外,还存在的两种作用力是
AD
AD
(填字母编号).
A.氢键 B.离子键 C.范德华力 D.配位键
(4)最近发现,只含X、Y和Ni三种元素的某种晶体具有超导性.X元素原子的2p能级的电子排布图为

,Y元素原子的价电子排布式为3s
2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
MgCNi3
MgCNi3
.


 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案