
【题目】铜及其化合物在生产生活中有着广泛的用途。
(1)基态铜原子的核外电子排布式为_____________。其晶体的堆积方式为__________________,
其中铜原子的配位数为_____________。
(2)向硫酸铜溶液中滴氨水,首先形成蓝色沉淀;继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液;继续向溶液中加入乙醇,会析出深蓝色晶体[Cu(NH3)4SO4·H2O]。
①氨水中各元素原子的电负性由大到小的顺序为_______________(用元素符号表示)。
②NH3中N原子的杂化轨道类型为_____________,与其互为等电子体的阳离子为__________。
③向蓝色沉淀中继续滴加氨水,沉淀溶解是因为生成了四氨合铜络离子,四氨合铜络离子的结构式
为____________;加入乙醇后析出晶体的原因为________________。
(3) CuCl2和CuCl是铜的两种常见的氯化物。
①下图表示的是________________ (填“CuCl2”或“CuCl”)的晶胞。
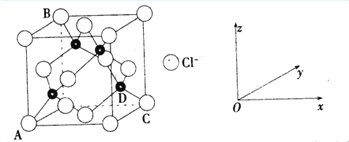
②原子坐标参数,表示晶胞内部各原子的相对位置,上图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为____________。
③上图晶胞中C、D两原子核间距为298 pm,阿伏伽德罗常数为NA,则该晶体密度为______g·cm-3(列出计算式即可)。
【答案】 ls22s22p63s23p63d104s1 面心立方最密堆积 12 O>N>H sp3 H3O+  降低溶剂极性,使Cu(NH3)4SO4H2O析出(合理答案即可) CuCl (
降低溶剂极性,使Cu(NH3)4SO4H2O析出(合理答案即可) CuCl (![]() ,
, ![]() ,
, ![]() )
) 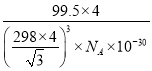
【解析】(1)铜的核电荷数为29,其基态铜原子的核外电子排布式为ls22s22p63s23p63d104s1;其晶体的堆积方式为面心立方最密堆积,其中铜原子的配位数为12;
(2)①氨水中存在的元素为H、N、O,元素的非金属性越强,电负性越大,则三种元素的电负性由大到小的顺序为O>N>H;
②NH3分子中N原子呈3个N-H键,N原子还原1对孤对电子对,杂化轨道数为4,N原子采取sp3杂化;与NH3分子互为等电子体的一种微粒具有相同的价电子数8和原子数4,阳离子微粒为H3O+;
③[Cu(NH3)4]2+为配合物,Cu2+为中心离子,电荷数为+2,NH3为配体,配位数为4,其结构式为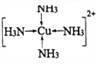 ;加入乙醇的目的是为了降低溶剂极性,使Cu(NH3)4SO4H2O析出;
;加入乙醇的目的是为了降低溶剂极性,使Cu(NH3)4SO4H2O析出;
(3)①晶胞中Cl-的个数为8![]() +6
+6![]() =4,Cu的个数为4,则化学式为CuCl,属于CuCl的晶胞;
=4,Cu的个数为4,则化学式为CuCl,属于CuCl的晶胞;
②D与周围4个原子形成正四面体结构,D与顶点C的连线处于晶胞体对角线上,且DC间距离为对角线的![]() 处,则D原子的坐标参数为(
处,则D原子的坐标参数为(![]() ,
, ![]() ,
, ![]() );
);
③已知一个晶胞中含有4个CuCl,设晶胞的边长为a,则CD间距离为![]() a,则a=
a,则a=![]() pm,则晶胞的体积为a3,晶胞的密度为
pm,则晶胞的体积为a3,晶胞的密度为![]() =
=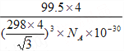 g/cm3。
g/cm3。
点晴:考查电负性及与金属性非金属性的关系等,清楚主族元素电负性的递变规律是解题关键,电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以非金属性越强电负性越强,故电负性最强的物质在周期表的右上角(零族元素除外);同周期自左而右电负性增大,同主族自上而下电负性降低,非金属性越强电负性越强,故金属性越强电负性越小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置。


(1)若利用甲实验,可通过观察__________________________现象,从而定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_____________________________,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:__________________________,若利用乙实验可进行定量分析,图中仪器A的名称为________________,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是_____________。
(2)将0.1 mol MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示,解释反应速率变化的原因:________________________________,H2O2初始物质的量浓度为__________(保留两位有效数字)。

(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5 g锌粒,通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸,10s时收集产生的H2的体积为44.8 mL(标准状况),用硫酸表示10 s内该反应的速率为________ mol·L-1·s-1(假设反应前后溶液的体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为 0.1 mol·L-1 的下列溶液: ①硫酸 ②醋酸 ③氢氧化钠
请回答下列问题:
(1)三种溶液中由水电离出的 H+浓度由大到小的顺序是(填序号)____________。
(2)已知 T ℃, KW=1×10-13,则 T ℃_________25 ℃(填“>”、 “<”或“=”)。在 T ℃时将pH=11的NaOH溶液a L与 pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则 a∶b=____________。
(3) 25 ℃时,有 pH=x 的盐酸和 pH=y 的氢氧化钠溶液(x≤6, y≥8),取 a L 该盐酸与 b L该氢氧化钠溶液反应,恰好完全中和,求:
①若 x+y=14,则 a/b=____________(填数据);
②若 x+y=13,则 a/b=____________(填数据);
③若 x+y>14,则 a/b=____________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的 pH 满足关系____________(用 x、 y 表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8 mL NO2和O2的混合气体通入倒立于水槽中装满水的量筒,充分反应后,剩余气体为1 mL,则原混合气体中NO2和O2的体积比可能为 ( )
A. 7∶5 B. 3∶7 C. 7∶1 D. 1∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A.NaHSO4=Na++H++SO42- B.NaHCO3=Na++H++CO32-
C.CH3COOH=CH3COO-+H+ D.H2CO32H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)为第VIA元素.其单质和化合物在化工生产等方面具有重要应用。
(1)TeO2微溶于水,易溶于较浓的强酸和强碱。与盐酸反应时生成四氯化碲,其化学方程式为________________。
(2)25℃时;亚碲酸(H2TeO3)的 Ka1=1×10-3,Ka2=2×10-8。该温度下,0.1mol·L-1 H2TeO3的电离度α约为______________(α=![]() ×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
(3)工业上常用铜阳极泥(主要成分为Cn2Te,还含有少量的Ag、Au)为原料制备单质碲,其工艺流程如下:
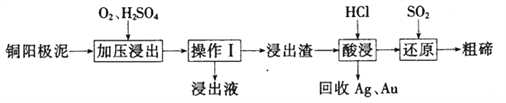
①实验室进行操作I时,下列仪器与该实验操作无关的为__________(填选项字母)。
A.长颈漏斗 B.烧杯 C.锥形瓶 D .玻璃棒
②已知‘浸出渣”的主要成分为TeO2。“加压浸出”时控制溶液pH为4.5~5.0,酸性不能过强的原因为_______________;“加压浸出”过程的离子方程式为______________________。
③“酸浸”后将SO2通入浸出液即可制得单质碲,则生成碲的化学方程式为________________。
④工业上还可以将铜阳极泥煅烧、碱浸后得到Na2TeO3,然后通过电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的 ( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL﹣1) | V/mL | c/(molL﹣1) | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态16N中,其s能电子云形状是_____形的,其p能级轨道上存在______个自旋方向相同的电子;CN-中共价键的类型有______。
(2)碱性肥料氰氮化钙(CaCN2)的组成元素第一电离能最小的是_______(填名称)。
(3)化合物(CH3)3N能溶于水,其原因是_______________,(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键类型为__________________.。
(4)阳离子[(CH3)3NH]+和阴离子A可按个数比4:1组成化合物,阴离子A的结构如图1所示,则S原子的杂化轨道类型是______,阴离子A的化学式为______。

(5)立方氮化硼的晶胞如图2所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为______;若晶胞边长为acm,则立方氮化硼的密度是______g·cm-3(只要求列算式,阿伏伽德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑦ |
| |||||
三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
四 | ② | ④ | ⑨ |
(1) 11种元素中,化学性质最不活泼的是________。(填元素符号,下同)
(2) ①②⑤中,最高价氧化物对应的水化物碱性最强的是________。(填对应的碱)
(3) ②③④中形成的简单离子半径由大到小的顺序是________________________。(填离子)
(4) 元素⑦的氢化物分子式为________,该氢化物与元素⑧的单质反应的离子方程式是______ 。
(5) ①和⑨的最高价氧化物对应的水化物的化学式为__________和________。①和⑨两元素形成化合物的化学式为____,该化合物的水溶液与元素⑧的单质反应的离子方程式为__________。
(6) ①和⑤最高价氧化物对应的水化物相互反应的化学方程式为________________。
(7) ⑧⑨![]() 三种元素形成的气态氢化物最稳定的是______________________。
三种元素形成的气态氢化物最稳定的是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com