
| 100×14% |
| 98 |
| 14 |
| 98 |
| 1 |
| 8 |
| 1 |
| 56 |
| 1 |
| 8 |
| 14 |
| 98 |
| 14 |
| 98 |
| 1 |
| 56 |
| 1 |
| 28 |
| 1 |
| 28 |
| 21,71 |
| 109.96 |
| 64 |
| 80 |


科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
反应结束后分离出溶液备用 |
|
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[其主要成分为Cu2(OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省定州中学高考复习综合测试化学试卷(带解析) 题型:实验题
(12分)某校的探究小组同学想研究氧化铜能否在氯酸钾的受热分解反应中起催化剂的作用,设计了以下的对比实验和操作步骤:
①任取两份氯酸钾,分别放入两支试管,在其中一份中加入经精确称量的n g氧化铜粉末。
②将两份氯酸钾同时在相同的条件下加热,将放出的气体通入水中,观察放出气体的快慢。
③停止加热、冷却,将原先混有氧化铜的反应后的混合物加水溶解,小心过滤,将滤出固体物质洗涤并干燥。
④观察滤出固体物质的状态、颜色。
⑤将滤出固体物质和炭粉混合,在密闭容器中加热,并将反应产生的气体通入澄清石灰水中,并观察实验现象。
(1)从以上有关实验步骤的叙述中可发现操作方案还存在一些缺陷,请指出并加以改进:
______________________________________________________________________、
______________________________________________________________________。
(2)有人换用另一种方法来代替上述第⑤操作,请从下图中选择仪器中连接成一套实验装置,这套实验装置的连接顺序是_______接______、________接______、________接________接_______(气流的方向从左往右)。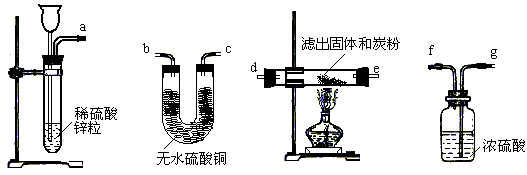
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省高考复习综合测试化学试卷(解析版) 题型:实验题
(12分)某校的探究小组同学想研究氧化铜能否在氯酸钾的受热分解反应中起催化剂的作用,设计了以下的对比实验和操作步骤:
①任取两份氯酸钾,分别放入两支试管,在其中一份中加入经精确称量的n g氧化铜粉末。
②将两份氯酸钾同时在相同的条件下加热,将放出的气体通入水中,观察放出气体的快慢。
③停止加热、冷却,将原先混有氧化铜的反应后的混合物加水溶解,小心过滤,将滤出固体物质洗涤并干燥。
④观察滤出固体物质的状态、颜色。
⑤将滤出固体物质和炭粉混合,在密闭容器中加热,并将反应产生的气体通入澄清石灰水中,并观察实验现象。
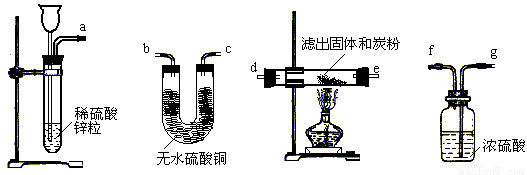
(1)从以上有关实验步骤的叙述中可发现操作方案还存在一些缺陷,请指出并加以改进:
______________________________________________________________________、
______________________________________________________________________。
(2)有人换用另一种方法来代替上述第⑤操作,请从下图中选择仪器中连接成一套实验装置,这套实验装置的连接顺序是_______接______、________接______、________接________接_______(气流的方向从左往右)。
查看答案和解析>>
科目:高中化学 来源: 题型:
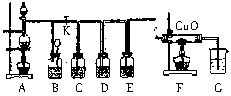
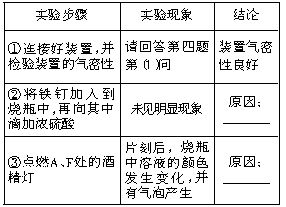
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com