
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的物质的量/原来的总物质的量)×100%。现取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为

A.0.5% B.1.5% C.0.1% D.1%
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:填空题
在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)=2HI(g)△H<0。
(1)保持容器容积不变,向其中加入1molH2,反应速率 理由是 。
(2)保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率 理由是 。
(3)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率________________,理由是________________。
(4)保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率________________,理由是______________。
(5)提高反应的起始温度,反应速率______________,理由是______________。
查看答案和解析>>
科目:高中化学 来源:2016届上海市高三上学期摸底测试化学试卷(解析版) 题型:选择题
有一种有机物的结构简式如下:
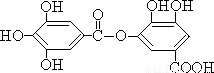
下列有关它的性质的叙述,正确的是
①它有弱酸性,能与氢氧化钠反应
②它不能发生水解反应
③它能发生水解反应,水解后生成两种物质
④它能发生水解反应,水解后只生成一种物质
A.只有① B.只有①② C.只有①③ D.只有①④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第二次月考化学试卷(解析版) 题型:选择题
已知有反应2NO + O2== 2NO2。今在体积为V L的密闭容器中通入a molNO 和b mol O2。反应后容器中的氮原子和氧原子的原子个数之比是
A.a/b B.a/2b C.a/(2a+2b) D.a/(a+2b)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川树德中学高一上10月阶段测化学试卷(解析版) 题型:选择题
可能由 Al、 Mg、 Cu、 Fe 中的若干金属组成的合金 2.4 克与足量的硫酸溶液反应, 产生标准状况时的氢气 2.24L,则关于合金的组成的叙述正确的是
A.一定有 Mg B.若有 Al 则一定有 Fe
C.若有 Cu 则一定有 Al D.若有 Mg 则一定有 Cu
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上第二次月考化学试卷(解析版) 题型:选择题
将1 mol冰醋酸加入到一定量的蒸馏水中最终得到1 L溶液。下列各项中,表明已达到电离平衡状态的是
A.醋酸的浓度达到1 mol·L-1
B.H+的浓度达到0.5 mol·L-1
C.醋酸分子的浓度、醋酸根离子的浓度、H+的浓度均为0.5 mol·L-1
D.醋酸分子电离成离子的速率和离子重新结合成醋酸分子的速率相等
查看答案和解析>>
科目:高中化学 来源:2016届湖南省衡阳市高三上学期第二次月考化学试卷(解析版) 题型:实验题
(16分)通过煤的气 化和液化,使碳及其化合物得以广泛应用。
化和液化,使碳及其化合物得以广泛应用。
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表。
t/min | 0 | 1 | 2 | 3 | 4 |
n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
则该温度下反应的平衡常数K= 。(保留2位有效数字)
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,此时v (正)_____________ v (逆)(填“>” “=” 或 “<”)。
II.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、726 kJ·mol-1。
(3)利用CO、H2合成液态甲醇的热化学方程式为 。
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响 。
III.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如右图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2—。

(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式 。
(6)已知一个电子的电量是1.602×10—19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH g。
Ⅳ.煤燃烧产生的CO2是造成温室效应的主 要气体之一。
要气体之一。
(7)将CO2转化成有机物可有效地实现碳循环。如:
a.6CO2+6H2O C6H12O6+6O2 b.2CO2 + 6H2
C6H12O6+6O2 b.2CO2 + 6H2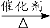 C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4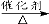 CH3COOH d.2CO2 + 6H2
CH3COOH d.2CO2 + 6H2 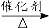 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,反应b中理论上原子利用率为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
如图曲线a和b是盐酸与氢氧化钠相互滴定的滴定曲线,下列叙述正确的是

A.盐酸的物质的量浓度为1 mol·L-1
B.P点时恰好完全反应,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
判断下列有关化学基本概念的依据正确的是
A.溶液与胶体:本质不同的原因是能否发生丁达尔效应
B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小
D.氧化还原反应:元素是否发生电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com