
| A. |  实验室制备及收集乙烯 | B. |  石油分馏 | ||
| C. |  实验室制硝基苯 | D. |  实验室制乙酸乙酯 |
分析 A.乙烯密度小于空气,应该采用向下排空气法收集;
B.蒸馏时,温度计测量馏分温度;
C.实验室用苯和浓硝酸在浓硫酸作催化剂、加热55-60℃制备硝基苯;
D.实验室制取乙酸乙酯时,导气管不能伸入饱和碳酸钠溶液中.
解答 解:A.乙烯密度小于空气,应该采用向下排空气法收集,但因为乙烯不易溶于水且乙烯密度接近空气密度,最好采用排水法收集,故A错误;
B.蒸馏时,温度计测量馏分温度,则温度计水银球应该位于蒸馏烧瓶支管口处,故B错误;
C.实验室用苯和浓硝酸在浓硫酸作催化剂、加热55-60℃制备硝基苯,该实验操作正确,故C正确;
D.实验室制取乙酸乙酯时,导气管不能伸入饱和碳酸钠溶液中,否则易产生倒吸现象,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离提纯、气体及物质制备等知识点,明确实验原理及物质性质差异性是解本题关键,注意BC中温度计水银球位置,为易错点.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题
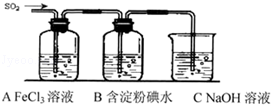 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z+n-m | B. | Z+m+n | C. | Z-n-m | D. | Z-n+m |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X元素的氢化物的水溶液显碱性 | |
| B. | Y元素最高价氧化物的晶体具有很高的熔点和沸点 | |
| C. | Z元素的单质在一定条件下能与X元素的单质反应 | |
| D. | W元素的氧化物对应水化物均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6O | B. | C2H4O | C. | C2H6 | D. | C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 取1.38g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加4.42g;若将燃烧产物通过浓硫酸,浓硫酸质量增加0.9g;已知:A的蒸气对氢气的相对密度为69.
取1.38g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加4.42g;若将燃烧产物通过浓硫酸,浓硫酸质量增加0.9g;已知:A的蒸气对氢气的相对密度为69.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验步骤 | 解释或实验结论 |
| (1)称取A 6.9g,升温使其汽化,测其密度是相同条件下CH4的8.625倍. | (1)A的相对分子质量为:138. |
| (2)将此6.9g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和15.4g | (2)A的分子式为:C7H6O3. |
| (3)另取A 6.9g,跟足量的NaHCO3粉末反应,生成1.12L CO2(标准状况),若与足量金属钠反应则生成1.12L H2(标准状况). | (3)用结构简式表示A中含有的官能团: -OH、-COOH. |
| (4)A的核磁共振氢谱显示A有6种氢 | A的结构简式 |
(5)写出A与浓溴水反应的方程式: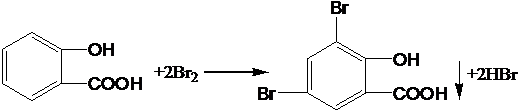 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | CuO+H2 $\frac{\underline{\;高温\;}}{\;}$ Cu+H2O | D. | Na2O+H2O═2NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com