
标准状况下,6.72 L NO2通入水后,收集到5.04 L气体,则被氧化的NO2的体积是( )
A.1.68 L B.2.52 L C.0.56 L D.1.12 L
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
下列图中的实验方案,能达到实验目的的是( )
| A | B | C | D | |
| 实验方案 |
|
将NO2球浸泡在冰水和热水中 |
|
|
| 实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 探究温度对平衡 2NO2 | 除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质与应用相对应的是 (  )
)
A.NH3极易溶于水,可用作制冷剂
B.Al2O3熔点高,可用作耐高温材料
C.SO2具有氧化性,可用于漂白品红、织物等
D.BaCO3能与盐酸反应,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50mg,则
A.被氧化的砒霜为1.98mg
B.分解产生的氢气为0.672ml
C.和砒霜反应的锌为3.90mg
D.转移的电子总数为6×10—5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
0.2 mol纯钠在只含氧气和氯气的密闭容器中燃烧,反应后冷却至常温,容器内固体 的质量不可能为 (
的质量不可能为 (  )。
)。
A.4.8 g B.6.2 g
C.7.8 g  D.11.7 g
D.11.7 g
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.34 g Cu和CuO的混合物加入约12 mol·L-1浓硫酸中,并加热使其完全溶解,然后用NaOH溶液中和过量硫酸,再用水稀释到0.5 L,加入纯铁粉1.85 g,反应后过滤、干燥,得不溶物1.89 g。求置换出的铜的质量及原混合物中铜的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.常温常压下,48gO3含有的氧原子数为3NA
B.1.8g的NH4+离子中含有的电子数为1.1NA
C.常温常压下,11.2L氧气所含的原子数为NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2—3cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 。
溶液注入容量瓶前需恢复到室温,这是因为_______________________________。
(4)若出现如下情况,对所配溶液浓度将有何影响?没有进行A操作 ;加蒸馏水时不慎超过了刻度 ;定容时俯视__________(填“偏低”“偏高”“无影响”)
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组取一定质量的FeSO4固体,利用下图装置进行实验。250mL容量瓶
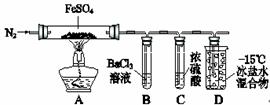
| 实验过程 | 实验现象 | |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2熔点–72℃,沸点–10℃;SO3熔点16.8℃,沸点44.8℃。
(1)实验③反应的离子方程式是 。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有______气体,依据是 。
(3)实验④反应的离子方程式是__ _____。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,原因是(用必要的文字和化学方程式解释)___ __ (填“正确”或“不正确”)理由
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com