
分析 (1)将反应后的混合气体用冰水冷却得40g无色晶体为SO3,剩余气体和过量H2S充分反应得44g固体为S,发生反应:2H2S+O2=2S↓+2H2O、2H2S+SO2=3S↓+2H2O,设反应后混合气体中O2为xmol、SO2为ymol,表示出生成 S的物质的量,根据三氧化硫计算消耗O2、SO2的物质的量,再根据S单质、氧气的质量列方程计算解答;
(2)根据S元素守恒计算FeS2的质量,进而计算样品中含FeS2的百分含量.
解答 解:(1)将反应后的混合气体用冰水冷却得40g无色晶体为SO3,其物质的量为$\frac{40g}{80g/mol}$=0.5mol,则:
O2(g)+2SO2(g)?2SO2(g)
1 2 2
0.25mol 0.5mol 0.5mol
剩余气体和过量H2S充分反应得44g固体为S,其物质的量为$\frac{44g}{32g/mol}$=1.375mol,氧气总物质的量为$\frac{24g}{32g/mol}$=0.75mol,设反应后混合气体中O2为xmol、SO2为ymol,则:
2H2S+O2=2S↓+2H2O、2H2S+SO2=3S↓+2H2O,
xmol 2xmol ymol 3ymol
故x+0.25=0.75,则x=0.5mol
2x+3y=1.375,解得y=0.125
故二氧化硫总物质的量为0.5mol+0.125mol=0.625mol,二氧化硫的转化率为$\frac{0.5mol}{0.625mol}$×100%=80%,
故答案为:80%;
(2)根据S元素守恒,m(FeS2)=$\frac{0.625mol}{2}$×120g/mol=37.5g,故样品中含FeS2的百分含量为$\frac{37.5g}{50g}$×100%=75%,
故答案为:75%.
点评 本题考查化学平衡计算,关键是明确冷却后剩余气体与过量硫化氢发生的反应,学生容易忽略氧气与硫化氢的反应.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ③⑦ | B. | ③④⑦ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
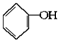 合成
合成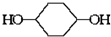 (部分试剂和反应条件已略去).
(部分试剂和反应条件已略去).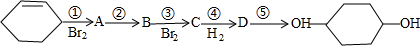
 、D
、D .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O
+2NaBr+2H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 50% | C. | 90% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②③ | C. | 只有②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{x}{28}$mol-1 | B. | $\frac{x}{14}$mol-1 | C. | 14x mol-1 | D. | 28x mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用锌粒和稀硫酸制H2 | B. |  用H2O2和MnO2制O2 | ||
| C. | 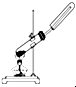 用氯化铵和氢氧化钙固体制NH3 | D. |  用铜片和稀硝酸制NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠加到冷水中:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 过量氢氧化钠溶液与氯化铝溶液反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO${\;}_{2}^{-}$+H2O | |
| D. | 氢氧化钡溶液中加入稀硫酸:H++OH-═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com