
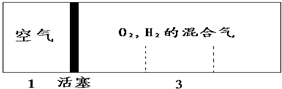
| A. | 2:7 | B. | 5:4 | C. | 1:1 | D. | 7:2 |
分析 反应前左右压强都相等,气体的物质的量之比等于体积之比,令空气的物质的量为1mol,则氢气、氧气的混合气体为3mol.反应后恢复至原来的温度,活塞正好停留在容器的中间.说明反应后左右气体的物质的量相等,右室中剩余气体为1mol,剩余的气体可能为氢气,也可能为氧气,据此讨论计算.
解答 解:反应前左右压强都相等,气体的物质的量之比等于体积之比,令空气的物质的量为1mol,则氢气、氧气的混合气体为3mol.反应后恢复至原来的温度,活塞正好停留在容器的中间.说明反应后左右气体的物质的量相等,右室中剩余气体为1mol,
若剩余的气体为氢气,参加反应气体共2mol,由2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O可知,氧气为2mol×$\frac{1}{3}$=$\frac{2}{3}$mol,故氢气为3mol-$\frac{2}{3}$mol=$\frac{7}{3}$mol,故H2、O2的体积比为$\frac{7}{3}$mol:$\frac{2}{3}$mol=7:2;
若剩余的气体为氧气,参加反应气体共2mol,由2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O可知,氢气为2mol×$\frac{2}{3}$=$\frac{4}{3}$mol,故氧气为3mol-$\frac{4}{3}$mol=$\frac{5}{3}$mol,故H2、O2的体积比为$\frac{4}{3}$mol:$\frac{5}{3}$mol=4:5,
故选D.
点评 本题考查化学方程式的有关计算,侧重考查学生分析计算能力,明确左右室的气体的物质的量关系是解答本题的关键,注意:该反应中可能是氧气过量也可能是氢气过量,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
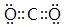 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程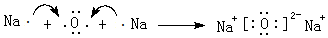 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ; F的化学式FeCl2.
; F的化学式FeCl2.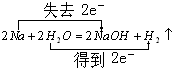 .反应②:
.反应②: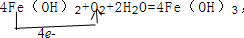 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛是一种氧化物 | |
| B. | 甲醛中C、H、O的质量比为6:1:8 | |
| C. | 甲醛分子中含有氢分子 | |
| D. | 甲醛是由一个碳原子和一个水分子构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 | |
| B. | Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即产生气体 | |
| C. | Na+、K+、Ag+,NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失 | |
| D. | NH4+、Al3+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻产生气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
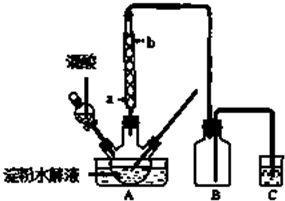
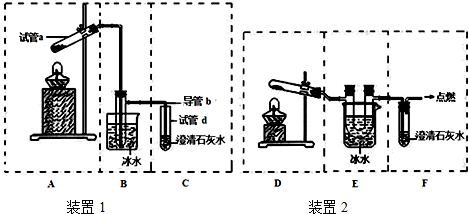
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com