
| A、某微粒空间构型为平面三角形,则中心原子一定是sp2杂化 |
| B、某微粒空间构型为V形,则中心原子一定有孤电子对 |
| C、某微粒空间构型为三角锥形,则该微粒一定是极性分子 |
| D、某微粒空间构型为正四面体,则键角一定是109°28’ |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g)?4NO2(g)+O2(g)△H>0 在低温下不能自发进行 |
这是一个熵增的反应 |
| B | 压缩针筒内的NO2和N2O4混合气体, 颜色先变深后变浅 |
增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C | 锌与稀硫酸反应过程中,开始某段时间反应速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度不一定降低 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:H2SO4>HClO4>HBrO4 |
| B、碱性:NaOH>KOH>RbOH |
| C、非金属性:P>S>Cl |
| D、气态氢化物稳定性:HF>H2O>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C、1.0×10-3mol/L盐酸的Ph=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、相同温度下,1 mol?L-1氨水溶液与0.5 mol?L-1氨水溶液中,c(OH-)之比是2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
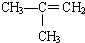 ⑥CaCO3 ⑦
⑥CaCO3 ⑦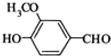 ⑧CH3CH2Br.
⑧CH3CH2Br.| A、①③④⑤ | B、⑥⑦⑧ |
| C、②⑦⑧ | D、②⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱金属元素与氧气反应均能形成过氧化物 |
| B、碱金属的密度随着原子序数的递增逐渐减小 |
| C、碱金属元素的最高价氧化物对应的水化物的碱性随着原子序数的递增依次增强 |
| D、碱金属元素的阳离子的氧化性随着原子序数的递增依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com