
【题目】锗是重要的半导体材料之一。碳、硅、锗位于同主族。
(1)基态锗原子的价层电子排布式为__________________。
(2)几种晶体的熔点和硬度如表所示。
晶体 | 金刚石 | 碳化硅 | 二氧化硅 | 硅 | 锗 |
熔点/℃ | 3 550 | 2 700 | 1 710 | 1 410 | 1 211 |
硬度 | 10 | 9.5 | 7 | 6.5 | 6.0 |
①碳化硅的晶体类型是__________________。
②二氧化硅的熔点很高,而干冰(固体二氧化碳)易升华,其主要原因是__________________。
③硅的熔点高于锗的,其主要原因是___________________________。
(3)![]() 的立体构型是________________;GeCl4分子中锗的杂化类型是__________________。
的立体构型是________________;GeCl4分子中锗的杂化类型是__________________。
(4)1个CS2分子中含_________个π键。
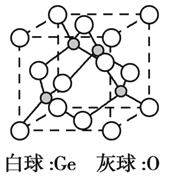
(5)锗的氧化物晶胞如图所示。已知:该氧化物的摩尔质量为M g·mol1,NA代表阿伏加德罗常数的值,晶胞密度为 ρ g·cm3。该晶胞的化学式为_________。氧原子的配位数为_________。该晶胞参数为_________cm(用代数式表示)。
 。
。
【答案】 4s24p2 原子晶体 二氧化硅是原子晶体,干冰是分子晶体 硅和锗都是原子晶体,硅的原子半径小于锗的,Si—Si键的键能大于Ge—Ge键的键能 平面三角形 sp3 2 GeO 4 ![]()
【解析】(1)锗的原子序数为32,价层电子排布式为4s24p2。
(2)①根据碳化硅的熔点和硬度知,碳化硅是原子晶体。②二氧化硅是原子晶体,而干冰是分子晶体,二氧化硅中存在较强的共价键,干冰中分子间作用力较弱。③硅和锗都是原子晶体,但是硅的原子半径小于锗的,故Si—Si键的键能大于Ge—Ge键的键能。
(3)![]() 中碳原子的价层有3对电子,孤电子对数为0,立体构型为平面三角形;GeCl4中锗的价层有4对电子,孤电子对数为0,锗的杂化类型为sp3。
中碳原子的价层有3对电子,孤电子对数为0,立体构型为平面三角形;GeCl4中锗的价层有4对电子,孤电子对数为0,锗的杂化类型为sp3。
(4)CS2的结构式为S=C=S,则1个CS2分子中含有2个π键。
(5)观察题给晶胞,8个Ge位于立方体顶点、6个Ge位于面心;4个O位于立方体内部。1个晶胞含4个Ge和4个O,化学式为GeO。观察图示知,1个O与4个Ge成键,氧原子的配位数为4。设晶胞参数为a cm,由ρ=![]()
![]() ,得:a=
,得:a=![]()
![]() 。
。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
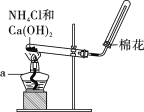
【题目】在实验室里,常用如图所示装置制取并收集氨气。请回答下列问题:
(1)原理与方法
①制取氨气的化学方程式为__________________________________;
②该收集氨气的方法为________。
A.向上排空气法 B.向下排空气法
(2)装置与操作
按下图组装仪器,进行实验。仪器a的名称为____________。
(3)思考与交流
①欲制取标准状况下4.48 L NH3,至少需要NH4Cl________g;
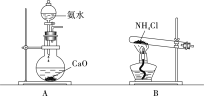
②实验室制取氨气,还可采用下图中的______(填“A”或“B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
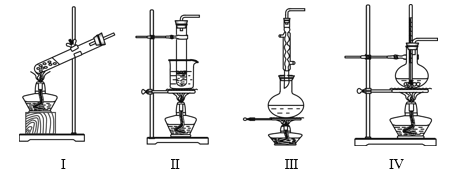
选项 | 实验目的 | 反应试剂及所需物质 | 选择装置 |
A | 制乙酸乙酯 | 无水乙醇、冰醋酸、浓硫酸、碎瓷片 | Ⅰ |
B | 进行银镜实验 | 银氨溶液、乙醛 | Ⅱ |
C | 制葡萄糖酸 | 葡萄糖、3%溴水 | Ⅲ |
D | 制乙烯 | 无水乙醇、浓硫酸、碎瓷片 | Ⅳ |
[注:葡萄糖与3%溴水在55 ℃左右反应]
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的部分内容。据此下列说法中正确的是( )
硫酸 化学纯CP
500 mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
A.该硫酸可以用来干燥硫化氢气体
B.1molZn与足量的该硫酸反应能产生2gH2
C.配制250mL4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
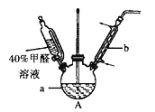
(1)在如图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50 mL和5 mol/LNaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热a,在65 ℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红褐色,并有气体产生。
①仪器b的名称是_________,作用为_________。
②能说明甲醛具有还原性的实验现象是______________。
(2)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应):
已知:Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
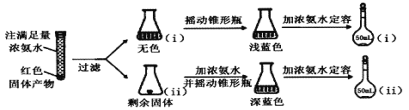
①摇动锥形瓶i的目的是_______。
②锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为_______。
③将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维尔纳配合物M是一种橙黄色单斜晶体,该晶体以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品中的氨全部蒸出,用500.00 mL 7.0 mol/L的盐酸溶液吸收,吸收结束后量取吸收液25.00 mL,用2.00 mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50 mL。
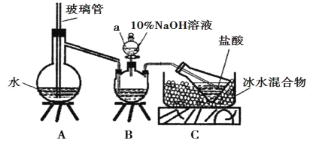
步骤二,氯的测定:准确称取橙黄色晶体w g,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)上述装置A中,玻璃管的作用是_________;
(2)装置A、B三脚架处应放置一个酒精灯作为热源,酒精灯应放置在_____(填“A”或“B”)处。
(3)步骤一所称取的样品中含氮的质量为______g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将______(填“偏高”“偏低”或“无影响”);冰水混合物的作用是_______________。
(5)测定氯的过程中,使用棕色滴定管的原因是________
(6)经上述实验测定,配合物M中钴、氮、氯的物质的量之比为1∶6∶3,其中氮元素以氨的形式存在。制备M的化学方程式为_____,其中双氧水的作用是____;制备M的过程中温度不能过高的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Al2(SO4)3和K2SO4的混合溶液200mL,将它均分成两份。一份滴加足量氨水,使Al3+完全沉淀;另一份滴加BaCl2溶液,使SO42﹣完全沉淀。反应中消耗a mol NH3H2O、b mol BaCl2.据此得知原混合溶液中的c(K+)为( )
A. (20b﹣10a)molL﹣1B. ![]() molL﹣1
molL﹣1
C. (10b﹣5a)molL﹣1D. ![]() molL﹣1
molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸是一种绿色生态杀菌剂,结构简式为 ,可用乙酸与过氧化氢一定条件下反应制得。下列说法不正确的是( )
,可用乙酸与过氧化氢一定条件下反应制得。下列说法不正确的是( )
A.过氧化氢的电子式![]()
B.乙酸溶于水:CH3COOH=CH3COO-+H+
C.过氧乙酸中含有极性共价键和非极性共价键
D.制备过氧乙酸的化学反应方程式:CH3COOH+H2O2![]() CH3COOOH+H2O
CH3COOOH+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com