
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀变为红褐色 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| B | 常温下,质量与表面积均相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| D | 向Na2SO3溶液加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | Na2SO3溶液已变质 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢氧化钠过量,铁离子直接与氢氧化钠反应生成氢氧化铁沉淀,无法比较二者溶度积大小;
B.常温下铝与浓硫酸发生钝化,阻止了反应的继续进行;
C.下层溶液显紫红色,说明铁离子将碘离子氧化成碘单质;
D.酸性条件下硝酸根离子能够氧化亚硫酸根离子,干扰了检验结果.
解答 解:A.加入的NaOH应该少量,否则铁离子直接与氢氧化钠反应,无法判断Ksp[Mg(OH)2]、Ksp[Fe(OH)3]的大小,故A错误;
B.常温下,质量与表面积均相同的铝片分别投入足量的稀、浓硫酸中,Al与浓硫酸发生钝化,则稀硫酸中铝先溶解完,故B错误;
C.将KI和FeCl3溶液在试管中混合后,加入CCl4振荡、静置,下层溶液显紫红色,说明有碘单质生成,可证明氧化性:Fe3+>I2,故C正确;
D.加入酸化的Ba(NO3)2溶液后,硝酸根离子在酸性条件下能够氧化亚硫酸根离子,干扰了检验,应该选用氯化钡溶液,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及难溶物溶度积大小比较、钝化现象、氧化还原反应、离子检验等知识,明确常见元素及其化合物性质为解答关键,D为易错点,注意酸性条件下硝酸根离子具有强氧化性,试题培养了学生的分析能力及化学实验能力.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水和酸性高锰酸钾溶液褪色的反应都属于氧化反应 | |
| B. | 乙酸和乙醇均能与NaOH溶液发生反应 | |
| C. | 苯与溴水混合后加入FeBr3做催化剂,可发生取代反应生成溴苯 | |
| D. | C5H11Br有8种同分异构体,它们的熔点、沸点各不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
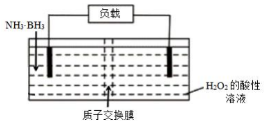 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | BO2-通过质子交换膜向正极移动 | |
| C. | 负极附近溶液pH增大 | |
| D. | 正极的反应式为 3H2O2+6H++6e-═6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 | 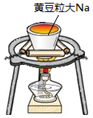 | 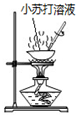 | 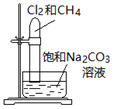 | 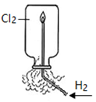 |
| 目的 | Na在空气中燃烧 | 提取NaHCO3晶体 | CH4与Cl2取代反应 | H2在Cl2中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
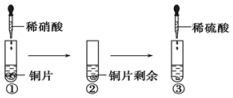
| A. | ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2 | |
| B. | ②中溶液存在:c(Cu2+)+c(H+)=c(NO3-)+c(OH-) | |
| C. | 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应 | |
| D. | ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、ClO‐、SO42‐、HCO3‐一定能共存于 c(Fe3+)=0.1mol•L‐l 的溶液中 | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 在NaClO和NaCl混合溶液中滴入过量SO2气体,反应的离子方程式为:SO2+3C1O‐+H2O═SO42‐+C1‐+2HClO | |
| D. | Na+、HCO3-、Br-、Mg2+可以在 pH=8 的溶液中共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
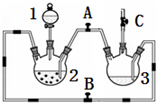 某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com