
����Ŀ�������ᣨH3PO2����һ�־�ϸ������Ʒ�����н�ǿ��ԭ�ԣ��ش��������⣺
��1��H3PO2��һԪ��ǿ�ᣬд������뷽��ʽ�� ��
��2��H3PO2�У���Ԫ�صĻ��ϼ�Ϊ ��
��3��NaH2PO2�����λ�����ʽ�Σ�����Һ���ԣ��������ԡ����ԡ����������ԣ���
��4��H3PO2Ҳ����ͨ�����ķ����Ʊ�������ԭ����ͼ��ʾ����Ĥ����Ĥ�ֱ�ֻ���������ӣ�������ͨ������ 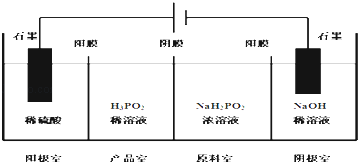
��д�������ĵ缫��Ӧʽ ��
�ڷ�����Ʒ�ҿɵõ�H3PO2��ԭ�� ��
�����ڲ��á����ҵ����������Ʊ�H3PO2 �� �������ҵ����������������ҵ�ϡ������H3PO2ϡ��Һ���棬����ȥ���������Ʒ��֮�����Ĥ���Ӷ��ϲ������������Ʒ�ң���ȱ�������ʣ������ʲ�����ԭ���ǣ� ��
���𰸡�
��1��H3PO2?H2PO2��+H+
��2��+1
��3��������
��4��2H++2e��=H2���������ҵ�H+������Ĥ��ɢ����Ʒ�ң�ԭ���ҵ�H2PO2��������Ĥ��ɢ����Ʒ�ң����߷�Ӧ����H3PO2��PO43����H2PO2����H3PO2������
���������⣺��1.��H3PO2��һԪ��ǿ�ᣬ��Һ�в��ֵ���������ӣ���������뷽��ʽΪH3PO2H2PO2��+H+ �� ���Դ��ǣ�H3PO2H2PO2��+H+��
��2.��H3PO2�У��ܻ��ϼ�Ϊ0��������Ԫ��Ϊ+1�ۣ���Ԫ��Ϊ��2�ۣ���PԪ�صĻ��ϼ�Ϊ+1�ۣ����Դ��ǣ�+1��
��3.������H3PO2��һԪ��ǿ�ᣬ����NaH2PO2ΪһԪǿ���һԪ��ǿ���γɵ����Σ����Ը�����Һ���ڳ�H2PO2������ˮ��������ԣ�����ʽΪH2PO2��+H2OH3PO2+OH�� �� ���Դ��ǣ����Σ������ԣ�
��4.��������������������Ϊ��������ӡ����������Ӻ�H2PO2�� �� ���зŵ�������ǿ�������������ӣ������������ĵ缫��ӦΪ��4OH����4e��=O2��+2H2O�������缫��Ӧ����Һ�������ӵõ����ӷ�����ԭ��Ӧ��2H++2e��=H2�����Դ��ǣ�2H++2e��=H2�����ڲ�Ʒ�ҿɵõ�H3PO2��ԭ������Ϊ�������ҵ�H+������Ĥ��ɢ����Ʒ�ң�ԭ���ҵ�H2PO2��������Ĥ��ɢ����Ʒ�ң����߷�Ӧ����H3PO2 �� ���Դ��ǣ������ҵ�H+������Ĥ��ɢ����Ʒ�ң�ԭ���ҵ�H2PO2��������Ĥ��ɢ����Ʒ�ң����߷�Ӧ����H3PO2�������ڲ��á����ҵ����������Ʊ�H3PO2 �� �������ҵ����������������ҵ�ϡ������H3PO2ϡ��Һ���棬����ȥ���������Ʒ��֮�����Ĥ���Ӷ��ϲ������������Ʒ�ң���ȱ���������������������H2PO2����H3PO2������PO43�� �� ��Ʒ�л���PO43�� ��
���Դ��ǣ�PO43����H2PO2����H3PO2��������
�����㾫����������Ĺؼ����������Ԫ�ؼ������֪ʶ������ԭ�ӽṹ�ص���ͬ�㣺������������Ϊ5����ͬ�㣺���Ӳ�����ͬ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ã�����ҺA��μ������B�У�����������ȷ���ǣ� ��

A. ��AΪŨ���ᣬBΪMnO2��C��ʢƷ����Һ����C����Һ��ɫ
B. ��AΪ���ᣬBΪ���ǣ�C��ʢ��������ʯ��ˮ����C����Һ�����
C. ��AΪŨ��ˮ��BΪ��ʯ�ң�C��ʢAlCl3��Һ����C���Ȳ�����ɫ������������ܽ�
D. ��AΪŨ���ᣬBΪNa2SO3���壬C��ʢʯ����Һ����C����Һ�ȱ�����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����͵���ڷ��ٷ�չ����Ϣ�����з�����Խ��Խ��Ҫ�����á�Li2FeSiO4�Ǽ��߷�չDZ������������ӵ�ص缫���ϣ���ƻ���ļ��������͵IJ�Ʒ���Ѿ�����һ���̶ȵ�Ӧ�á�����һ���Ʊ�Li2FeSiO4�ķ���Ϊ�����෨��2Li2SiO3��FeSO4![]() Li2FeSiO4��Li2SO4��SiO2
Li2FeSiO4��Li2SO4��SiO2
ijѧϰС�鰴����ʵ�������Ʊ�Li2FeSiO4���ⶨ���ò�Ʒ��Li2FeSiO4�ĺ�����
ʵ��(һ)�Ʊ����̣�

ʵ��(��) Li2FeSiO4�����ⶨ��

������B��ȡ20.00 mL��Һ����ƿ�У���ȡ0.2000 mol��L��1������KMnO4����Һװ������C�У���������ԭ�ζ����ⶨFe2+��������ط�ӦΪ��MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O�����ʲ�������KMnO4����Һ��Ӧ����4�εζ���ÿ������KMnO4��Һ��������£�
ʵ����� | 1 | 2 | 3 | 4 |
����KMnO4��Һ��� | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
��1��ʵ��(��)�е��������ƣ�����B ������C ��
��2���Ʊ�Li2FeSiO4ʱ�����ڶ��������Χ�н��У���ԭ���� ��
��3���������IJ��� ���ڲ�����ʱ�������õ��IJ��������У�������ͨ©�����ձ��⣬���� ��
��4����ԭ��A����SO2��д���÷�Ӧ�����ӷ���ʽ ����ʱ������������ҪĿ���� ��
��5���ζ��յ�ʱ����Ϊ �����ݵζ��������ȷ����Ʒ��Li2FeSiO4����������Ϊ �����ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ�����ʧ����ʹ��õ�Li2FeSiO4���� ��������ƫ��������ƫ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���ѧ������������ѧʽ������ϵ��ǣ� ��
A. ̼���ơ����Na2CO3 B. ̼�����ơ�С�մ�NaHCO3
C. �������ơ���NaOH D. ̼��ơ���ʯ�ҡ�CaCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʻ���(O��C��S)�㷺��������úΪԭ�ϵĸ��ֻ���ԭ�����У�����������ж�����ѧ��Ʒ�����½��ʹ�����Ⱦ���ʻ������ⷴӦ��ˮ�ⷴӦ�����ֳ��õ��������䷴Ӧʽ�ֱ�Ϊ:
����ⷴӦ:COS(g)+H2(g)![]() H2S(g)+CO(g) ��H1=+7kJ/mol
H2S(g)+CO(g) ��H1=+7kJ/mol
��ˮ�ⷴӦ:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ��H2
H2S(g)+CO2(g) ��H2
��֪��Ӧ����صĻ�ѧ��������������:
��ѧ�� | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
E/kJ��mol-1 | 803 | 742 | 577 | 339 | 465 |
�ش���������:
��1���������ѳ�COS�ķ�Ӧ�У���ij��Ӧ��1mol���ӷ���ת�ƣ���÷�Ӧ���յ�����Ϊ____kJ��
��2����֪�Ȼ�ѧ����ʽCO(g)+H2O(g)![]() H2(g)+CO2(g) ��H3������H3=_____kJ/mol��
H2(g)+CO2(g) ��H3������H3=_____kJ/mol��
��3��ij�¶��£���ij�ܱ������н���COS����ⷴӦ
������Ӧ�ﵽ�Ⱥ����������������������Ӧ����_____(��������������С������������)��
���������������ʱ������ʼʱ����COS��H2�������Ϊ1:2�����������ܱ�����Ӧ�ﵽƽ��״̬����______��
a.�����ܶȲ��� b.COS��H2Ũ�ȱȲ���
c.��������ƽ����Է����������� d.COS�����������
���������������ʱ����COS��H2����ʼ���ʵ�����Ϊ1:a��ƽ���COS��H2�����ʵ�����Ϊ1:10a������¶���H2ƽ��ת����Ϊ______(�ú�a��ʽ�ӱ�ʾ)��
��4���ʻ��������ˮ�ⷴӦ�ܷ���Ƴ�ԭ���_____(�ܻ��)��������________��
��5���ý����������(MH)����(Pt)��������Һ��ɵ�ԭ��ؿ���ʹ�ʻ�����������
��ԭ��صĸ���������____(�ѧʽ)��
��д��ԭ��ص�������Ӧʽ_________��������Χ��ҺpH______(����������С������������)��
��ԭ��ع���ʱ��������Һ��������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����������������Ӧ�ù㷺��
��1���������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ������Ӧ��2N2(g)��6H2O��1��![]() 4NH3(g)��3O2(g)
4NH3(g)��3O2(g) ![]() H=��1530 kJ��mol-1����֪��H2O(g) = H2O��1��
H=��1530 kJ��mol-1����֪��H2O(g) = H2O��1�� ![]() H=��44.0 kJ��mol-1����4NH3(g)��3O2(g)
H=��44.0 kJ��mol-1����4NH3(g)��3O2(g)![]() 2N2(g)��6H2O(g)
2N2(g)��6H2O(g) ![]() H =_____kJ��mol-1���ں��º����ܱ������У����÷�Ӧ����ƽ��״̬ʱ����ʹƽ��������Ӧ�����ƶ��ҷ�Ӧ���ʼӿ죬���д�ʩ���е���_____��������ĸ��
H =_____kJ��mol-1���ں��º����ܱ������У����÷�Ӧ����ƽ��״̬ʱ����ʹƽ��������Ӧ�����ƶ��ҷ�Ӧ���ʼӿ죬���д�ʩ���е���_____��������ĸ��
A����ƽ�������г���Ar B����ƽ�������г���O2
C�����ø��õĴ��� D�����ͷ�Ӧ���¶�
��2�����ð�����ȡ����[CO(NH2)]�ķ�ӦΪ��2NH3(g)��CO2(g)![]() CO(NH2)2(s)��H2O(g)��H��0��ij�¶��£�������Ϊ1L���ܱ�������ͨ��4 mol NH3��2molCO2���÷�Ӧ���е�40sʱ���ﵽƽ�⣬��ʱCO2��ת����Ϊ50%����ͼ�е����߱�ʾ��ǰ25s��NH3��Ũ����ʱ��ı仯���������������������������ʹ�ô�����������ͼ����ʵ����c(NH3)��ʱ��ı仯���ߡ�_______________��
CO(NH2)2(s)��H2O(g)��H��0��ij�¶��£�������Ϊ1L���ܱ�������ͨ��4 mol NH3��2molCO2���÷�Ӧ���е�40sʱ���ﵽƽ�⣬��ʱCO2��ת����Ϊ50%����ͼ�е����߱�ʾ��ǰ25s��NH3��Ũ����ʱ��ı仯���������������������������ʹ�ô�����������ͼ����ʵ����c(NH3)��ʱ��ı仯���ߡ�_______________��

�� �������¶Ⱥ�����������䣬��ƽ����ϵ����ͨ��2molNH3��2molH2O����ʱv��______v�����>������=����<����
��3����������(NaN3)������������ȫ�����У���ҵ ����NaN3��Ҫ����175��ʱ��NaNO3��ĩ�ӵ��ۻ���NaNH2�У�����������ֳ����ļ������ʣ���д���������̵Ļ�ѧ����ʽ_______________________��
��4���ǰ�NH2OH���Կ�����NH3�����ڵ�һ����ԭ�ӱ��ǻ�ȡ��������������ᡢ����ˮ��Һ������ʽ��е�⣬�ڹ��缫��NO3-��ת��ΪNH2OH���Բ�Ϊ��һ������õ�ⷴӦ���ܻ�ѧ����ʽ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������� J ��ij�ֽ�����ʹҩ���� A Ϊԭ�ϵĹ�ҵ�ϳ�·������ͼ�� ʾ��

��֪
����ʽ B: C8H8O2 C:C8H7NO4 D:C6H5NO3 E :C6H7NO F:C9H11NO2 H:C6H 7O3
��1��д��ͬʱ�������������� F ������ͬ���칹��Ľṹ��ʽ_____
���� a�������(a ̼���뺬����ԭ��) �� NMR �ױ��������к��б���
��2������˵������ȷ����_____
A�������� C ���������������
B�������� E �ȿ����� NaOH ��Ӧ�ֿ����� HCl ��Ӧ
C�������� F ���� FeCl3 ������ɫ��Ӧ
D�������� J �ķ���ʽΪ C18H15NO5
��3����� G��H �ĺϳ�·��(������ͼ��ʾ�����Լ���ѡ)_____
��4��д�� I+F��J �Ļ�ѧ����ʽ_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Դ�������Դ����Ϊ����Դ�������������й�����Դ��������ȷ����
A.��ʯȼ���ǿ�������ԴB.���ܡ�̫�����������Դ
C.��ʯȼ�϶��������ԴD.�����ܡ��������Dz��������������Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ڼ�����Һ�пɷ������·�Ӧ��2R(OH)3 + 3ClO- + 4OH-=2RO4n- + 3Cl- + 5H2O����RO4n-��R�Ļ��ϼ���
A.+6B.+5C.+4D.+3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com