
汽车剧烈碰撞时,安全气囊中发生反应: 。则下列判断错误的是
。则下列判断错误的是
A.该反应能在瞬间完成,并产生大量气体
B.生成标准状况下2.24L气体,该反应转移电子的物质的量为0.5mol
C.该反应中的氧化剂为KNO3
D.被氧化和被还原的N原子的物质的量之比为15:1
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)已知:
(X为卤原子,M为烃基或含酯基的取代基等)
由有机物A合成G(香豆素)的步骤如下:
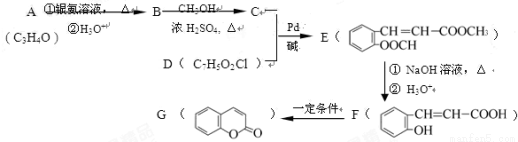
回答下列问题:
(1)写出A中所含官能团名称: ,F→G 的反应类型是 。
(2)写出B→C的化学方程式 。 (3)D的结构简式为 。
(4)F有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式: 。
Ⅰ.分子中除苯环外,无其它环状结构;
Ⅱ.苯环上有两个处于对位的取代基;
Ⅲ.能发生水解反应,不能与Na反应;
Ⅳ.能与新制Cu(OH)2按物质的量比1:2反应
(5)二氢香豆素( )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体( )需要用到的试剂有:NaOH溶液、 。
)需要用到的试剂有:NaOH溶液、 。
(6)已知: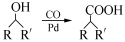 (R,R′为烃基),试写出以苯和丙烯(
(R,R′为烃基),试写出以苯和丙烯( =CH—CH3)为原料,合成
=CH—CH3)为原料,合成 的路线流程图(无机试剂任选)。合成路线流程图示例如下:
的路线流程图(无机试剂任选)。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.500 mL 2 mol·L-1 FeCl3溶液中Fe3+数为NA,且 =3
=3
B.1 L pH=1的硫酸溶液中含有的H+为0.2NA
C.标准状况下,22.4L 乙烷中含极性共价键的数目为7NA
D.12 g石墨和C60的混合物中质子总数一定为6NA个
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三上学期期中理综化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中能大量共存的是
A.在无色溶液中: Na+、Cu2+、NO3- 、MnO4-
B.在含有HCO3-的溶液中:H+、K+、SO42-、Cl-
C.PH=1的溶液中:Na+、 K+、AlO2-、SO42-
D.常温下,水电离的c(H+)=10-12mol·L-1的溶液中:K+、Ba2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(7分)现有部分元素的原子结构特点如下表:
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 最外层电子数是次外层电子数的2.5倍 |
(1)画出W原子结构示意图:_____ _______。
(2)元素X与元素Z相比,非金属性较强的是__ ____(填元素符号),写出一个能表示X、Z非金属性强弱关系的化学反应方程式:___________ _________________。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为_______ _。
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,元素W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式:______ _________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法中不正确的是
A.标准状况下,1.12L的H2O所含的原子数大于0.15NA
B.常温常压下,1mol甲基(—14C1H3)所含有的中子数和电子数分别为8NA和9NA
C.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
D.在1L0.1mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列表示物质结构的化学用语或模型正确的是
A.8个中子的碳原子的核素符号:12C
B.HF的电子式:
C.Cl-离子的结构示意图:
D.CH4分子的比例模型:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.将过量SO2通入少量氨水中:SO2+2NH3·H2O==2NH4++SO32-
B.实验室用Cu和稀HNO3反应制取少量NO气体:Cu+4H++NO3- ==Cu2++NO↑+2H2O
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O
D.KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O==3I2+6OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:填空题
(13分)
Ⅰ、回答下列问题
1)、已知常温下,在NaHSO3溶液中c(H2SO3 ) < c(SO32 -),且H2SO3的电离平衡常数为K1=1.5×10-2
K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;则等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2CO3 ③KHSO3 ④KHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列顺序为_____________
2)、NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘,试写出此反应的离子反应方程式_______________________________________
3)、在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是_________________,用离子方程式表示产生上述现象的原因:__________________
Ⅱ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)①在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。请写出计算过程____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com