
 )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应: +2H+ ═ I2+2H2O
+2H+ ═ I2+2H2O
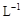 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·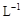 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。 (4)否
(4)否 ,则根据反应②可知,双氧水和碘化钾反应生成的单质碘的物质的量是
,则根据反应②可知,双氧水和碘化钾反应生成的单质碘的物质的量是 。根据反应④可知,反应中生成的单质碘的物质的量共计是
。根据反应④可知,反应中生成的单质碘的物质的量共计是 ,所以过氧乙酸与碘化钾反应生成的单质碘的物质的量是
,所以过氧乙酸与碘化钾反应生成的单质碘的物质的量是 ,所以根据③反应可知,过氧乙酸的物质的量是
,所以根据③反应可知,过氧乙酸的物质的量是 ,所以过氧乙酸的浓度是
,所以过氧乙酸的浓度是 mol/L。
mol/L。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3:2 | B.3:5 | C.3:8 | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2CO(g) ΔH2="+172.5" kJ/mol ②
2CO(g) ΔH2="+172.5" kJ/mol ② 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.小于0.45 mol | B.等于0.45mol |
| C.大于0.45mol | D.在0.45mol和0.9mol之间 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化剂与还原剂的物质的量之比为1:8 |
| B.还原产物为NH4+ |
| C.若有1mol NO3-参加还原反应,转移8mole- |
| D.该反应中H2O是反应物之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com