
A.该反应从氧化还原反应的电子转移角度看,与SO2+2H2S====3S↓+2H2O是同一种类型
B.该反应中,氧元素氧化了硫元素
C.该反应从氧化还原反应的电子转移角度看,与6NO2+8NH3![]() 7N2+12H2O是一种类型
7N2+12H2O是一种类型
D.该反应中,Cu2S既是还原剂又是氧化剂
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

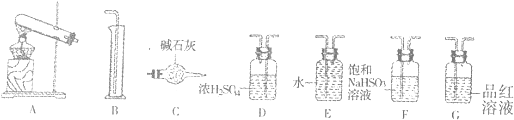
查看答案和解析>>
科目:高中化学 来源: 题型:
 由黄铜矿(主要成分是CuFeS2)可以冶炼得到粗铜,再经过电解精炼得到纯铜.
由黄铜矿(主要成分是CuFeS2)可以冶炼得到粗铜,再经过电解精炼得到纯铜.
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省赣州市高三上学期期末联考理综化学试卷(解析版) 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
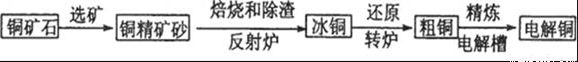
(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是__________、__________,反射炉内生成炉渣的主要成分是__________;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98. 5%的粗铜,该过程发生反应的化学方程式分别是__________、__________。
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极_____(填图中的字母);在电极d上发生的电极反应式为____________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com