
����Ŀ���������������
(1)д���ɼױ��Ʊ��������ױ��Ļ�ѧ����ʽ��________��
(2)ij�л������ʽ��C3H2O2������ˮ��Һ����������ʹ��ˮ��ɫ�����л���Ľṹ��ʽΪ________��
(3)![]() ���ӽṹ�������________��ԭ�ӹ��档
���ӽṹ�������________��ԭ�ӹ��档
(4)�����м��ַ�Ӧ���ͣ�����ȥ��ȡ���������ܼӳɢݻ�ԭ��ˮ�⣬�ñ�ȩ��ȡ1��2-����������ȷ�ĺϳ�·�����η����ķ�Ӧ�������Ͳ�������________��
A.�ݢ٢ܢ�B.�ܢ٢ܢ�C.�ݢ٢ܢ�D.�ݢۢޢ�
(5)������A����ʽΪC5H8�����Ǻϳ���Ȼ�ĵ��壬����A�ϳɵ���Ȼ��˳ʽ�ṹ��ʽΪ________��
(6)��̼���� ���������ã����������������ɻ��ĵ��粣�����Լ��۾���Ƭ�����̡���Ƭ�ȡ��ϳɾ�̼����������ɫ��ѧԭ��̼�������(
���������ã����������������ɻ��ĵ��粣�����Լ��۾���Ƭ�����̡���Ƭ�ȡ��ϳɾ�̼����������ɫ��ѧԭ��̼�������( )��________(д�����л���Ľṹ��ʽ�����Ͼۺ϶��ɡ�
)��________(д�����л���Ľṹ��ʽ�����Ͼۺ϶��ɡ�
���𰸡�  CH2=CH-COOH 20 D
CH2=CH-COOH 20 D 

��������(1)�ױ���Ũ���������Ũ���ᷢ��ȡ�����������������ױ����䷴Ӧ�Ļ�ѧ����ʽΪ�� ��(2)����ʽΪC3H4O2���л����ˮ��Һ����������ʹ��ˮ��ɫ����Ϊ��ϩ�ᣬ��ṹ��ʽΪCH2=CH-COOH��
��(2)����ʽΪC3H4O2���л����ˮ��Һ����������ʹ��ˮ��ɫ����Ϊ��ϩ�ᣬ��ṹ��ʽΪCH2=CH-COOH��
(3) ����̼̼������ͬһֱ���ϣ�̼̼˫���ͱ�����ƽ���νṹ���ҵ����ǿ�����ת�ģ����Ը��ݽṹ��ʽ���жϣ����������е�̼ԭ�Ӷ��ǹ���ģ������ϵ���ԭ����1���ǿ��ܹ���ģ�����![]() ������20��ԭ�ӹ��棻(4) �ñ�ȩ��ȡ1��2һ�������������ŷ����仯����������Ŀ�仯��1��2һ��������2���ǻ����Ҵ������ڵ�̼ԭ���ϣ�����Ӧ���Ʊ���ϩ���ȼ��ԭΪ��������Ũ������������·�����ȥ��Ӧ���ñ�ϩ��������ӳɣ��Ƶ�1��2һ������飬Ȼ�����ڼ��ˮ��Һ������ˮ�⣬��1��2һ���������ʺϳ�·�����η����ķ�Ӧ��������˳��Ϊ�ݢ٢ܢ�ݢ٢ܢڻ�ܢ٢ܢڣ���ѡD��(5)������A����ʽΪC5H8�����Ǻϳ���Ȼ�ĵ��壬��Ϊ�����ϩ������A�ϳɵ���Ȼ��˳ʽ�ṹ��ʽΪ��
������20��ԭ�ӹ��棻(4) �ñ�ȩ��ȡ1��2һ�������������ŷ����仯����������Ŀ�仯��1��2һ��������2���ǻ����Ҵ������ڵ�̼ԭ���ϣ�����Ӧ���Ʊ���ϩ���ȼ��ԭΪ��������Ũ������������·�����ȥ��Ӧ���ñ�ϩ��������ӳɣ��Ƶ�1��2һ������飬Ȼ�����ڼ��ˮ��Һ������ˮ�⣬��1��2һ���������ʺϳ�·�����η����ķ�Ӧ��������˳��Ϊ�ݢ٢ܢ�ݢ٢ܢڻ�ܢ٢ܢڣ���ѡD��(5)������A����ʽΪC5H8�����Ǻϳ���Ȼ�ĵ��壬��Ϊ�����ϩ������A�ϳɵ���Ȼ��˳ʽ�ṹ��ʽΪ��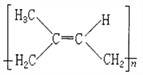 ����6�����ݾ�̼����
����6�����ݾ�̼���� �Ľṹ��ʽ��֪���ϳɾ�̼����������ɫ��ѧԭ��̼�������(
�Ľṹ��ʽ��֪���ϳɾ�̼����������ɫ��ѧԭ��̼�������(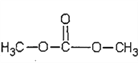 )��
)��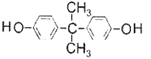 ���Ͼۺ϶��ɡ�
���Ͼۺ϶��ɡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӷ�Ӧ����ѧ��ѧ����Ҫ�ķ�Ӧ���ͣ��ش��������⣺
��1���ڷ������ӷ�Ӧ�ķ�Ӧ����������У�һ������ �� ������ţ�
�ٵ��ʡ���������۵���ʡ����Ρ��ݻ�����
��2���õ����ŷ�������з���ʽ�ĵ���ת����Ŀ�ͷ���MnO4��+5Fe2++8H+�TMn2++5Fe3++4H2O
��3����եƻ��֭������ϲ�������ϣ����ڴ������к���Fe2+ �� ��ե��ƻ��֭�ڿ����л��ɵ���ɫ��Fe2+��Ϊ�ػ�ɫ�� Fe3+ �� �����ɫ�Ĺ����е�Fe2+�������������ԭ����������ե֭��ʱ�����������ά����C������Ч��ֹ��������ķ�������˵��ά����C���У� ��
A�������� B����ԭ�� C������ D�����ԣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ڵȵ�������ǣ� ��
A.N2O4��NO2B.CH4��NH4+C.CO2��NO2D.C2H6��N2H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ϡ���������·���ˮ�ⷴӦֻ����һ�ֲ������( )
A. ���� B. ������ C. ��֬ D. ��ѿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.�����仯����֮����ת��������ʽ��ʾ��
![]()
�ش������й����⣺
��1��������������Һ���Ƿ����Fe2+�ķ�����_____________________________________��
��2���ɷ��Ʊ��������Ƶ���Ҫ��ӦΪ2FeSO4+6Na2O2= 2Na2FeO4+2Na2O+2Na2SO4+O2��
�÷�Ӧ�е���������______________��ÿ����l mol Na2FeO4ת��_____________mol���ӡ�
��3��ʪ���Ʊ��������(K2FeO4)�ķ�Ӧ��ϵ������������
Fe(OH)3��ClO-��OH-��FeO42-��Cl-��H2O��
��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��___________________________________��
������Ӧ������ת����0.3 mol���ӣ���ԭ��������ʵ���Ϊ______________________��
II.ij��ѧС��ͨ���������ϣ����������ͼ��ʾ�ķ����Ժ����ϴ���Ϊԭ�����Ʊ�NiSO4��7H2O����֪ij�������ĺ����ϴ�����Ҫ����Ni��������Al(31��)��Fe(1��3��)�ĵ��ʼ������������������(3.3��)��

����������������������ʽ����ʱ��pH���£�

��1��������������з�����Ӧ��������_________________���ѧʽ����
��2���������ʱ����������� _________________ (�ѧʽ)��
��3������H2O2ʱ������Ӧ�����ӷ���ʽΪ_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�е� �� H �ܱ�ʾ����ȼ���ȵ��� �� ��
A. 2CO(g)��O2(g)=2CO2(g) ��H=��556kJ��mol��1
B. CH4(g)��2O2(g)=CO2(g)��2H2O(l) ��H=��890kJ��mol��1
C. 2H2(g)��O2(g)=2H2O(l) ��H=��571.6kJ��mol��1
D. H2(g)��Cl2(g)=3HCl(g) ��H=��184.6kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯����ȡ����Ӧ����
A.������ˮ��ϣ�ˮ����ɫ
B.��ϩʹ������Ȼ�̼��Һ��ɫ
C.�ױ����������ױ�
D.����������һ���������������Ȼ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ɻ�ͭ��(��Ҫ�ɷ�CuFeS2)ұ��ͭ����Ҫ����������
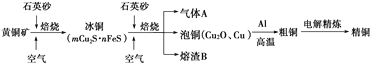
��1������A�еĴ�����Ⱦ���ѡ�������Լ��е�________���գ�
a��ŨH2SO4������b��ϡHNO3 c��NaOH��Һ d����ˮ
��2����ϡH2SO4��������B��ȡ����������Һ���μ�KSCN��Һ��ʺ�ɫ��������Һ�л�����Fe2���ķ�����________________________(ע���Լ�������)��
��3������ͭұ����ͭ�Ļ�ѧ��Ӧ����ʽΪ ________________________________
��4����CuSO4��ҺΪ�������Һ���д�ͭ(��Al��Zn��Ag��Pt��Au������)�ĵ�⾫��������˵����ȷ����________��
a������ȫ��ת��Ϊ��ѧ�� b����ͭ�ӵ�Դ����������������Ӧ
c����Һ��Cu2���������ƶ� d������������ɻ���Ag��Pt��Au�Ƚ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com