
| A. | 硒化氢的稳定性比水的弱 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 硒的氧化性比硫的强 | |
| D. | 硒的最高价氧化物对应的水化物酸性比砷的强 |
分析 硒为第四周期第ⅥA族元素,其性质与O、S元素相似但非金属性小于O元素、S元素;
A.元素的非金属性越强,其氢化物的稳定性越强;
B.H2Se与H2S性质类似,H2S的水溶液显弱酸性;
C.元素的非金属性越强,其单质的氧化性越强;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:硒为第四周期第ⅥA族元素,其性质与O、S元素相似但非金属性小于O元素、S元素;
A.元素的非金属性越强,其氢化物的稳定性越强,非金属性Se<O,则硒化氢的稳定性比水的弱,故A正确;
B.H2Se与H2S性质类似,H2S的水溶液显弱酸性,则硒化氢的水溶液显弱酸性,故B正确;
C.元素的非金属性越强,其单质的氧化性越强,非金属S>Se,则硒的氧化性比硫的弱,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Se>As,则硒的最高价氧化物对应的水化物酸性比砷的强,故D正确;
故选C.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素原子结构和性质递变规律是解本题关键,根据同一主族元素性质相似性和递变性分析解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
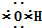
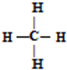
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04mol•L-1 | B. | 0.04mol•L-1•s-1 | C. | 0.08mol•L-1 | D. | 0.08mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C->D2->A+>B2+ | B. | B2+>A+>C->D2- | C. | B2+>A+>D2->C- | D. | D2->C->A+>B2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com