
| A、0.1mol?L-1 CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 |
| C、pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等 |
| D、在NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |


科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 2min末浓度/mol?L-1 | 0.08 | a | b |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、平衡时,X的转化率为20% |
| B、t℃时,该反应的平衡常数为40 |
| C、增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 |
| D、前2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

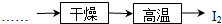
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是中学化学中某些物质之间的相互转化关系.已知C、D、G、H、K为单质,其他为化合物;A是一种常见的液态化合物,J为淡黄色固体,E对玻璃具有很强的腐蚀性;G、K是碳素钢中的两种重要元素,其中K含量少;E、F对应溶液的酸碱性相反,F的焰色反应为黄色.请按要求作答:
如图是中学化学中某些物质之间的相互转化关系.已知C、D、G、H、K为单质,其他为化合物;A是一种常见的液态化合物,J为淡黄色固体,E对玻璃具有很强的腐蚀性;G、K是碳素钢中的两种重要元素,其中K含量少;E、F对应溶液的酸碱性相反,F的焰色反应为黄色.请按要求作答:查看答案和解析>>
科目:高中化学 来源: 题型:
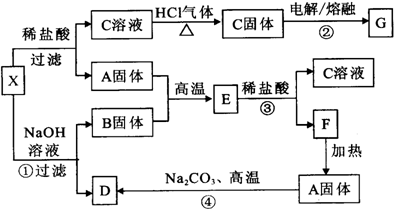 下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.
下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、17g羟基中含有的电子数为10NA |
| B、12.0g熔融的NaHSO4中含有的阳离子数为0.2NA |
| C、常温常压下,30g乙酸与30g葡萄糖含有的氧原子数均为NA |
| D、常温下,5.6g Fe投入到足量浓硝酸中,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Fe3+、SO42-、I- |
| B、H+、NH4+、HCO3-、NO3- |
| C、Ag+、K+、Cl-、SO42- |
| D、K+、AlO2-、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、HCO3-、NO3- |
| B、Na+、NH4+、NO3-、Cl- |
| C、K+、Na+、NO3-、Br - |
| D、K+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
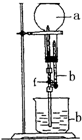 硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.试回答下列问题:
硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com