
【题目】A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示:
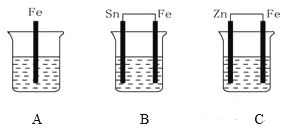
(1)A中反应的离子方程式是______。
(2)B中Sn极的电极反应式为____,Sn极附近溶液的pH____(填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是____,总反应离子方程式是____,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是____。
【答案】Fe+2H+![]() Fe2++H2↑ 2H++2e-
Fe2++H2↑ 2H++2e-![]() H2↑ 增大 Zn Zn+2H+
H2↑ 增大 Zn Zn+2H+![]() Zn2++H2↑ B>A>C
Zn2++H2↑ B>A>C
【解析】
(1)A中铁与稀硫酸反应生成硫酸亚铁和氢气;
(2)装置B构成Sn、Fe原电池,Fe的活泼性大于Sn, Fe作负极、Sn作正极。
(3)装置C构成Zn、Fe原电池,Fe的活泼性小于Zn, Fe作正极、Zn作负极。
(1)A中铁与稀硫酸反应生成硫酸亚铁和氢气,反应离子方程式是Fe+2H+![]() Fe2++H2↑;
Fe2++H2↑;
(2)装置B构成Sn、Fe原电池,Fe的活泼性大于Sn, Fe作负极,负极反应式是Fe-2e- ![]() Fe2+, Sn作正极,正极反应式是2H++2e-
Fe2+, Sn作正极,正极反应式是2H++2e-![]() H2↑,正极氢离子浓度减小,所以Sn极附近溶液的pH增大。
H2↑,正极氢离子浓度减小,所以Sn极附近溶液的pH增大。
(3)装置B构成Zn、Fe原电池,Fe的活泼性小于Zn, Fe作正极, Zn作负极。总反应是锌与硫酸反应生成硫酸锌和氢气,反应离子方程式是Zn+2H+![]() Zn2++H2↑;A中铁发生化学腐蚀,B中铁作原电池负极,腐蚀速率加快,C中Fe作正极,铁被保护,所以A、B、C中铁被腐蚀的速率由快到慢的顺序是B>A>C。
Zn2++H2↑;A中铁发生化学腐蚀,B中铁作原电池负极,腐蚀速率加快,C中Fe作正极,铁被保护,所以A、B、C中铁被腐蚀的速率由快到慢的顺序是B>A>C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某传感器工作原理如图所示。利用该传感器可以测定空气中NO、CO、NH3、SO2等有害气体的含量。下列说法正确的是
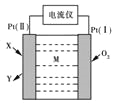
A. 传感器工作中,电子由Pt(Ⅰ)极经电流仪传到Pt(Ⅱ)极
B. 若M为熔融KOH,X为NH3,Y为N2,则负极的电极反应式为2NH3-6e- = N2+6H+
C. 若M是含O2-的固体电解质,X为NO,则正极的电极反应式为O2 + 4e- = 2O2-
D. 若X为CO,M为KOH溶液,则电池总反应为2CO+O2 = 2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原料从杨树中提取,现可用如下反应制备:
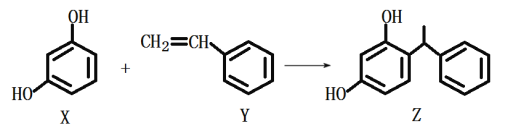
下列叙述错误的是
A. X、Y和Z均能使溴水褪色,且原理相同
B. X和Z均能与Na2CO3溶液反应放出CO2
C. Z中含手性碳原子
D. Y可作加聚反应的单体,X可作缩聚反应的单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:
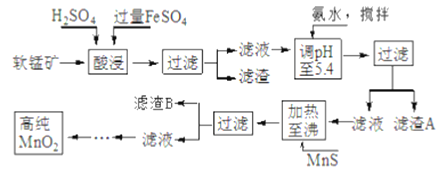
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-35 | 10-6 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH 至少达到____________,恰好能使Fe3+、A13+沉淀完全。(当离子浓度降到1.0×10-5mol·L-1时即视为沉淀完全)
(3)滤渣B的成分是___________________。
(4)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极电极反应式为_____________________________________________________。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI 溶液充分反应后,配制成100mL溶液。取其中20.00mL,恰好与25.00mL 0.0800mol·L-1Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算可得该样品纯度_____%。(小数点后保留1位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)画出磷原子的原子结构示意图:______。
(2)写出H2S分子的电子式:________。
(3)写出表示含有8个质子,10个中子的原子的化学符号:______。
(4)已知阴离子aXm—和阳离子bYn+具有相同的核外电子排布,则a、b、m、n之间的关系为a=____。
(5)用电子式表示氯化镁的形成过程:____。
(6)写出Na2O2中所含化学键的类型______。
(7)拆开1mol H—H键,1mol N—H键, 1mol![]() 键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3___热量(填“吸收”或“放出”)___kJ;
键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3___热量(填“吸收”或“放出”)___kJ;
(8)利用下列反应:Fe+Cu2+=Fe2++Cu 制一个化学电池,写出电极反应式:负极:___;正极__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成生石灰;②在海水中加入生石灰,过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中加热晶体;⑤电解上述所得盐(熔融条件下)。下列说法正确的是( )
A.向洗涤液中滴加氯化钙溶液可检验沉淀是否洗涤干净
B.上述变化过程中包括了分解、化合、复分解、置换等四种反应类型
C.步骤④在氯化氢热气流中加热晶体的目的是为了防止氯化镁水解
D.步骤⑤也可以采用电解该盐水溶液的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是
A.为了防止食品受潮变质,常在食品包装袋中放入生石灰
B.不可用铝制餐具长时间存放酸性或碱性食物
C.明矾可用于净水
D.为防止铁制品生锈,可以在铁制品的外层涂油漆或局部镀铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W、G在元素周期表中的相对位置如下表所示,其中Q是无机非金属材料的主角。下列判断正确的是( )
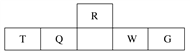
A. 离子半径:T<W<G
B. 等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多
C. 最简单气态氢化物的热稳定性:Q<R
D. T和G组成的化合物溶于水,其水溶液呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com