
| A、Na与水反应比与C2H5OH反应强烈 |
| B、丙酮(CH3COCH3)分子中的氢原子比乙烷分子中的氢原子更易被卤素原子取代 |
| C、甲酸的酸性比乙酸强 |
| D、相等质量的甲醇和乙醇分别与足量金属钠反应,甲醇产生的H2更多 |


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
| Y | Z | W | ||
| X | Q |
| A、元素Y、Z、W、Q均可与氢元素形成一种或多种氢化物,其中YH4中 H的质量分数最大 |
| B、由元素X与元素W组成的物质既能溶于足量的稀盐酸,又能溶于足量的氨水 |
| C、元素Y、Z、W的单质晶体一定是同种类型的晶体 |
| D、为了增强Q单质水溶液的漂白性,可将与W同主族且相邻的元素的低价氧化物通入其中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的盐酸的Cl-浓度和pH=3的醋酸溶液的CH3COO-浓度 |
| B、pH相同的氨水和醋酸钠溶液中,由水电离产生的c(H+) |
| C、0.1mol/L的盐酸和0.1mol/L的醋酸分别与金属镁反应的速率 |
| D、pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水中加入固体氢氧化钠后,溶液中有c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | ||
B、加水稀释0.2 mol?L-1的醋酸溶液后,溶液中
| ||
| C、pH=3的弱酸HR溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应,反应后的溶液中一定有:c(R-)+c(HR)=0.05mol?L-1 | ||
| D、0.2 mol?L-1的CH3COOH溶液与0.1 mol?L-1NaOH溶液等体积混合后溶液呈酸性,则c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:邻羟基苯甲醛>对羟基苯甲醛 |
| B、酸性:H2SO4>H2CO3>HCO3->Al(OH)3 |
| C、溶解度:Na2CO3>NaHCO3>MgCO3 |
| D、稳定性:Na2CO3>NaHCO3>H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “502”胶水是以α-氰基丙烯酸乙酯(结构如图所示)为主,溶有阻聚剂SO2等制备而成.若本品露置,接触空气中微量水汽,即迅速聚合固化,故称“瞬干胶”.则下列有关α-氰基丙烯酸乙酯和SO2说法不正确的是( )
“502”胶水是以α-氰基丙烯酸乙酯(结构如图所示)为主,溶有阻聚剂SO2等制备而成.若本品露置,接触空气中微量水汽,即迅速聚合固化,故称“瞬干胶”.则下列有关α-氰基丙烯酸乙酯和SO2说法不正确的是( )| A、α-氰基丙烯酸乙酯分子中存在σ键π键 |
| B、α-氰基丙烯酸乙酯比SO2沸点低 |
| C、水在“502”胶水聚合固化中起催化作用 |
| D、粘在手上的“502”胶水可以用酒精等有机溶剂清除 |
查看答案和解析>>
科目:高中化学 来源: 题型:
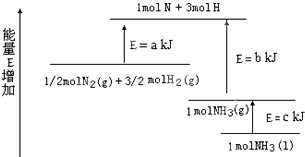
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com