
无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如下图所示(夹持仪器略去)。主要步骤如下:
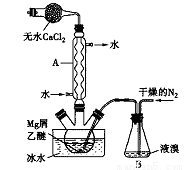
步骤l:三颈瓶中装入10g镁屑和150mL无水乙醚,装置B中加入适量的液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3:反应完毕后恢复至室温,过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5= MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是___________,它在实验中的作用是____________。
(2)步骡2中,可以将B装置中的溴完全导入三颈瓶中的原因是_______;该实验如果将所用液溴一次性全部加入三颈瓶中,其后果是_____________。
(3)步骡3中,第一次过滤得到的固体物质是______;根据步骤3、4,请总结出三乙醚合溴化镁所具有的物理性质:_________。
(4)请根据Mg的性质设计实验证明O2的氧化性比N2的强:________。
(5)将步骤得到的产品在干燥器中冷却到室温后,称量,其质量为61.4g。则该实验制取MgBr2的产率是_____________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g) △H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1) △H2=-57.3kJ/mol
下列结论正确的是( )
A. 若碳的燃烧热用△H3来表示,则△H3<△H1
B. 若碳的燃烧热用△H3来表示,则△H3>△H1
C. 浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
D. 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
关于下列装置的说法,正确的是
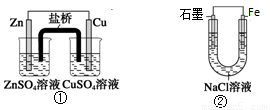
A. 装置①中,盐桥中的K+移向CuSO4溶液
B. 装置①中,Zn为负极,发生还原反应
C. 装置②中的Fe发生析氢腐蚀
D. 装置②中电子由Fe流向石墨,然后再经溶液流向Fe
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(五)理综化学试卷(解析版) 题型:实验题
氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下图所示。

回答下列问题:
(1)CuCl中Cu元素在周期表中的位置为___________。
(2)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为________。溶解温度应控制在60~70℃,原因是______________。
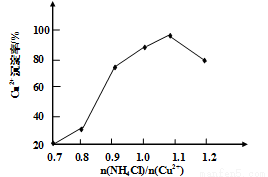
(3)写出步骤③中主要反应的离子方程式________。(NH4)2SO3要适当过量,目的有:保证Cu2+的还原速率,__________。已知NH4Cl、Cu2+的物质的量之比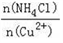 与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
(4)步骤⑥加入乙醇洗涤的目的是__________。
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解;
②用0.100mol·L-1硫酸铈[Ce(SO4)2]标准溶液测定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
平衡实验次数 | 1 | 2 | 3 |
0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_______(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(五)理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 丙烯分子中所有原子有可能在同一平面上
B. 乙醇、乙酸和苯可用溴水区分
C. 分子式为C4H8O2并能与乙醇发生酯化反应生成的有机物有2种
D. 苯的硝化反应、乙醇和氧气制乙醛属于同一类反应类型
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三3月高考适应性测试理综化学试卷(解析版) 题型:选择题
下列有关实验操作、现象、解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3可作防火剂 |
B | 将H2再充满Cl2的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2化合生成HCl |
C | 将SO2通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2具有漂白性 |
D | 出去表面氧化膜的铝箔,在酒精灯上充分加热 | 铝不能滴落下来 | 铝熔点高,没能熔化 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:简答题
三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]•3H2O)有很重要的用途.可用如图流程来制备.根据题意完成下列各题:
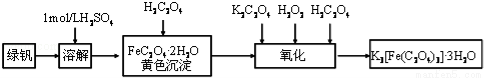
(1)要从溶液中得到绿矾,必须进行的实验操作是 .(按前后顺序填写)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4﹣被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤3:在酸性条件下,用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00ml,滴定中MnO4﹣,被还原成Mn2+.
(2)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;
主要操作步骤依次是:称量、溶解、转移、 、定容、摇匀.
(3)步骤2中,加入锌粉的目的是 .
(4)步骤3中,发生反应的离子方程式为: .
(5)步骤2中,若加入的KMnO4的溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”、“不变”)
(6)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体(是物质的量之比为4:5的混合气体).研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:选择题
下列化学用语表示正确的是
A. Mg2+的结构示意图: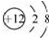 B. 葡萄糖的结构简式:C6H12O6
B. 葡萄糖的结构简式:C6H12O6
C. H2O2的电子式: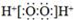 D. 硫酸的电离方程式:H2SO4═H22++SO42﹣
D. 硫酸的电离方程式:H2SO4═H22++SO42﹣
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省湛江市高二上学期期末调研考试化学试卷(解析版) 题型:填空题
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0. 20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为__________________________,表中b_________c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为__________________mol·L-1,0~20s内N2O4的平均反应速率为________________;
(3)该反应的平衡常数表达式K=___________________
在80℃时该反应的平衡常数K值为:______________(保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时____________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com