
【题目】丙烯醇(CH2= CH-CH2OH)可发生的化学反应有 ( )
①加成 ②氧化 ③燃烧 ④取代
A.只有①②B.只有①②③C.只有①③D.①②③④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某小组同学通过“FeSO4被浓HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预期现象 | 实验现象 |
向盛有2 mL FeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体,溶液变为深棕色 |
(1)红棕色气体是_______。
(2)实验现象与预期不符,继续进行实验。
取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明_______。
实验二:探究溶液变为深棕色的原因
(资料与猜想)
查阅资料后猜想,可能是生成的NO2或NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
(实验与探究)
用下图所示装置进行实验(气密性已检验,尾气处理已略去)
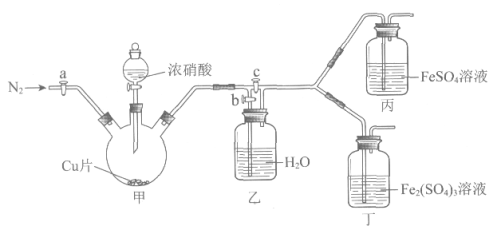
i. 关闭c,打开a和b,通入N2,一段时间后关闭a;
ii. 向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
iii. 关闭b、打开c,更换丙、丁中的溶液(试剂不变);
iv. 继续向甲中加入浓HNO3,一段时间后观察到了与ii相同的实验现象。
(1)通入N2的目的是________。
(2)铜与浓硝酸反应的化学方程式是________。
(3)装置乙的作用是________。
(4)实验结论是________。
(反思与改进)
实验三:验证Fe2+的还原性
该小组同学依据实验二的结论改进了实验一,观察到了预期现象,其实验操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,a L氢气在过量的bL氯气中燃烧,所得混合物用100mL3.00mol·L-1的NaOH溶液恰好完全吸收,则氯气的体积b为( )
A. 2.24L B. 4.48L C. 3.36L D. 1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格。
(演示实验)将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
(学生回答)该反应的化学方程式___________________________。
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
(假设猜想)针对疑问,大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是____。
(实验探究)(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有___________。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究.
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的.
(评价反思)老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
①实验操作中的错误是____________________。
②实验方案中也有一个是错误的,错误的原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是( )
A.Na+、CO32﹣、SO42﹣、H+
B.K+、OH﹣、H+、Cl﹣
C.Mg2+、H+、NO3﹣、SO42﹣
D.Fe3+、K+、OH﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R 是其中的五种元素。下列说法正确的是
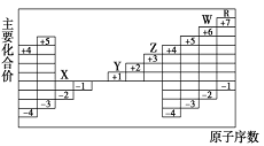
A. 离子半径: Y+>X2-
B. Y+、Z3+、W2-、R-在水中能大量共存
C. 氢化物的稳定性: H2W>H2X
D. 工业上利用电解熔融态YR和Z2X3的方法制取金属Y和乙单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甲同学用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)并测量其结晶水含量。己知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。制取流程如下:
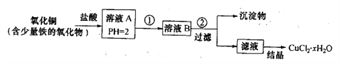
回答下列问题:
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂____(填编号)
①KMnO4 ②K3[Fe(CN)6] ③NaOH ④KSCN
(2)试剂①是_____,试剂②是_____。(填化学式)
(3)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得黑色固体的质量为ng。沉淀洗涤的操作方法是________,根据实验数据测得x=_____(用含m、n的代数式表示)。
II.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。回答下列问题:
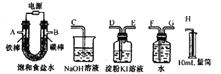
(4)所选仪器接口的连接顺序是A接______,______接______;B接______,______接______;___________请用离子方程式说明淀粉KI溶液变蓝的原因_____________________________。
(5)若装入的饱和食盐水为75mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4mL(已转换成标准状况下的体积)时停止通电。将U形管内的溶液倒入烧杯,常温时测得溶液的pH约为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L-1NaOH溶液150mL。原硫酸溶液的浓度是
A. 0.5mol·L-1 B. 1mol·L-1 C. 1.5mol·L-1 D. 2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不能体现相关主旨的是
A. “水域蓝天,拒绝污染”一严控PM 2.5排放,改善雾霾天气
B. “化学,让生活更美好”一积极开发风力发电,让能源更清洁
C. “节能减排,低碳经济”一综合利用煤和石油,发展绿色化学
D. “化学,引领科技进步”一研究合成光纤技术,让通讯更快捷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com