
|
PH=4的H2SO4 溶液与PH=4的NH4NO3溶液,由水电离出的H+浓度的比值是 | |
| [ ] | |
A. |
1 |
B. |
106 |
C. |
10-6 |
D. |
10-5 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013届安徽省高二年级3月月考化学试卷 题型:选择题
某温度下,水的离子积常数KW=10-12。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
A.1∶10 B.10∶1 C.9∶1 D.99∶21
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题

查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
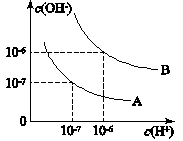
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则α________(填“<”“>”或“=”)1×10-14,作出此判断的理由是___________。
(2)25 ℃下,某Na2SO4溶液中c(SO![]() )=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
(3)t2 ℃下,pH=7的溶液显________性(填“酸”、“碱”或“中”),将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________,此溶液中各种离子的浓度由大到小的排列顺序是__________________。
查看答案和解析>>
科目:高中化学 来源:0131 期中题 题型:填空题
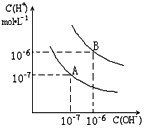
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com