��2010?�ij�һģ��ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W����Ԫ�ص�ԭ������֮��Ϊ32�������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ�Y��Z�������ڣ�Z��Wλ��ͬ���壮
��1��WԪ����Ԫ�����ڱ��е�λ��
��������VIA��
��������VIA��
��
��2������X��Y��Z����Ԫ����ɵ����ֳ�������A��B��C�ֱ������ᡢ��Σ����к������Ӽ�������Ϊ
NH4NO3
NH4NO3
���ѧʽ����
��3����X��Y��Z��W����Ԫ���е�������ɵ�һ��ǿ�ᣬ��ǿ���ϡ��Һ����ͭ��Ӧ�����ӷ���ʽΪ
3Cu+2NO3-+8H+�T3Cu2++2NO��+4H2O
3Cu+2NO3-+8H+�T3Cu2++2NO��+4H2O
��
��4����������Ѱ����ʵĴ����͵缫���ϣ���X
2��Y
2Ϊ�缫��Ӧ���HCl-NH
4Cl��ҺΪ�������Һ��������ȼ�ϵ�أ���д���õ���ܷ�Ӧʽ
N2+H2+HCl��NH4Cl
N2+H2+HCl��NH4Cl
���û�ѧʽ��ʾ����Ҫ����ƽ�����ŵ�ʱH
+����
��
��
���������������
��5����X��Y��Z��W��һ�ֳ�������Ԫ�������Է�������Ϊ392�Ļ�����D��1mol D�к���6mol�ᾧˮ���Ի�����A��������ʵ�飺
a��ȡ����0.1mol D����Һ�������ŨNaOH��Һ�����ȣ�������ɫ������4.48L����״������ɫ�̼�����ζ���壮��һ��ʱ���ɫ������Ϊ����ɫ�����ձ�Ϊ���ɫ��
b�����Ժ���0.1mol D����Һ���������BaCl
2��Һ����46.6g��ɫ������������������ܽ⣮
��D�Ļ�ѧʽΪ
��NH4��2Fe��SO4��2?6H2O
��NH4��2Fe��SO4��2?6H2O
��
����25���£��ⶨŨ�Ⱦ�Ϊa mol/L�Ļ�����B��D�Ļ����ҺpH=7���Һ��������ӵ�Ũ��Ϊb mol/L������Һ�г�H
+�������������������Ũ��Ϊ
4a-2b
4a-2b
mol/L��







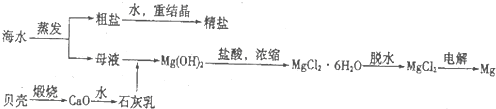



 ��
�� ��
�� ��
��
 ��
�� ��
�� ��
��