
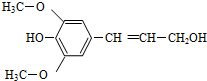
 膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )| A. | 芥子醇的分子式是C11H12O4 | |
| B. | 芥子醇分子中所有碳原子可能在同一平面 | |
| C. | 1mol芥子醇能与足量溴水反应消耗3molBr2 | |
| D. | 1mol芥子醇与足量的氢气反应消耗氢气4mol |
分析 该有机物中含有醚基、酚羟基、碳碳双键和醇羟基,具有醚、酚、烯烃和醇的性质,据此分析解答.
解答 解:A.该分子的分子式是C11H14O4,故A错误;
B.分子中含有苯环、乙烯等基础分子的共面结构,单键可以旋转,所有碳原子可能在同一平面,故B错误;
C.苯环上酚羟基邻对位不存在氢原子,只有碳碳双键和溴发生加成反应,所以1mol芥子醇能与足量溴水反应消耗1molBr2,故C错误;
D.苯环和碳碳双键都能和氢气发生加成反应,所以1mol芥子醇与足量的氢气反应消耗氢气4mol,故D正确;
故选D.
点评 本题考查物质结构和性质,明确物质官能团及其性质的关系是解本题关键,熟练掌握常见有机物官能团,难点是原子共面的判断,易错选项是B.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子式为C7H8O,且含苯环的有机化合物有4种 | |
| B. | 乙醇能使酸性高锰酸钾溶液褪色 | |
| C. | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的使酸性KMnO4溶液褪色的气体只是乙烯 | |
| D. | 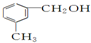 遇FeCl3溶液可显紫色 遇FeCl3溶液可显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学变化都伴随着能量变化 | |
| B. | 任何反应中的能量变化都表现为热量变化 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 所有化学反应都可以设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3->BrO3->IO3->Cl2 | B. | BrO3->Cl2>IO3->ClO3- | ||
| C. | BrO3->ClO3->Cl2>IO3- | D. | Cl2>BrO3->ClO3->IO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA | |
| B. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 标准状况下,2.24 L CHCl3的原子总数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (任写一种).
(任写一种). .
.
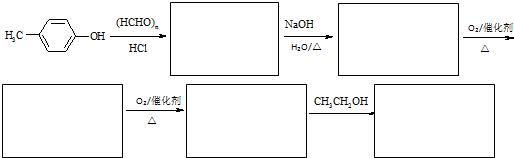
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
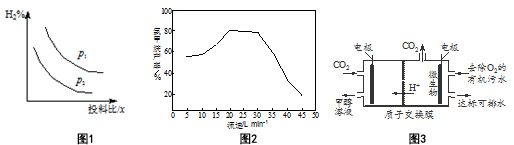
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
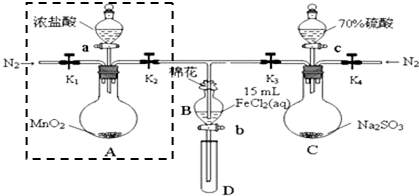
| 过程⑤B溶液中含有的离子 | 过程⑦B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
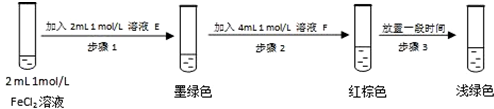
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com