
| A | B | C | D | |
| 实验 | 用酒精提取溴水中的Br2 | 除去氢氧化铁胶体中的铁离子 | 分离NH4Cl和I2的固体混合物 | 稀释10mL98% 的浓硫酸溶液 |
| 装置或仪器 | 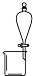 |  |  | 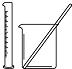 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酒精和水混溶;
B.胶粒能透过滤纸;
C.碘加热升华,氯化铵加热分解;
D.稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌.
解答 解:A.酒精和水混溶,不能用作萃取剂,应用苯或四氯化碳,故A错误;
B.胶粒能透过滤纸,无法除掉,故B错误;
C.碘加热升华,氯化铵加热分解,则加热不能分离,故C错误;
D.稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的分离提纯以及溶液的稀释等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:填空题
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.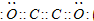 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4bc}{a}$NAL | B. | $\frac{22.4ab}{c}$NAL | C. | $\frac{22.4ac}{b}$NAL | D. | $\frac{22.4b}{ac}$NA L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | Kw/c(OH-)=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
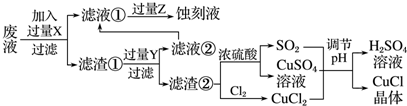
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3═NH4++HCO3- | B. | Ba(NO3)2═Ba2++2NO3- | ||
| C. | Ca(OH)2═Ca2++(OH)2- | D. | KAl(SO4)2═K++Al3++2SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com