
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是( )
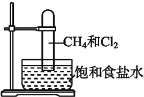
A. 此反应无光照也可发生
B. 盛放饱和食盐水的水槽底部会有少量晶体析出
C. 甲烷和Cl2反应后的产物只有CH3Cl和HCl
D. CH4和Cl2完全反应后液面上升,液体充满试管
【答案】B
【解析】
甲烷与氯气在光照条件下发生取代反应,反应产物有一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳四种卤代烃,同时还有氯化氢生成,所以反应产物为混合物;卤代烃不溶于水中,因此在试管内壁有油状液滴出现,据此进行判断。
A. 甲烷和氯气发生取代反应,必须在光照条件下进行,A项错误;
B. 发生取代反应生成的HCl溶于氯化钠溶液后,能使氯化钠的溶解度降低,故能使饱和氯化钠溶液中有晶体析出,B项正确;
C. 甲烷和Cl2反应后生成的CH3Cl能继续和氯气发生取代,从而生成二氯甲烷、三氯甲烷和四氯化碳,C项错误;
D. 甲烷和氯气取代后生成的一氯甲烷为气体,其它有机产物均为液态,且生成的HCl溶于水,故此甲烷和氯气的反应为气体的物质的量减少的反应,故会导致液面上升,但液体不能充满整个试管,D项错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________;得到滤渣1的主要成分为________________。
(2)第②步加入H2O2的作用是______________________________________,使用H2O2的优点是______________________________________________;调节pH的目的是使_______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
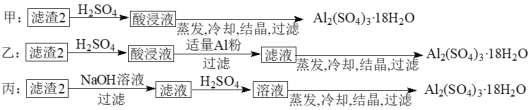
上述三种方案中,______方案不可行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个装置,下列说法错误的是( )
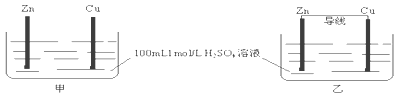
A. 甲、乙装置中,Zn的质量均减小B. 甲、乙装置中,Cu上均有气泡产生
C. 化学反应速率乙>甲D. 甲中H+移向Zn,乙中H+移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中不正确的是
A. 某密闭容器中盛有0.2 mol SO2和0.1 mol O2,一定条件下充分反应,生成SO3分子数小于0.2 NA
B. 一定条件下,2.3 g Na与O2完全反应生成3.6 g产物时失去的电子数0.1 NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为 0.1 NA
D. 20g D2O中含有的质子数为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天飞船可用肼(N2H4)作动力源。已知1 g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05 kJ热量,化学方程式为N2H4+2H2O2=N2↑+4H2O。下列说法中错误的是 ( )
A. 肼(N2H4)分子中只存在极性共价键
B. 此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ
C. 该反应中肼作还原剂
D. 该反应的反应物总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、实验现象和实验结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将Al2(SO4)3溶液和NaHCO3溶液混合 | 产生白色沉淀,并有大量气体生成 | 生成Al2(CO3)3沉淀和CO2气体 |
B | 在淀粉溶液中加入几滴稀硫酸,水浴5min,加入NaOH溶液调溶液pH至碱性,再加入新制的Cu(OH)2悬浊液,加热 | 有红色沉淀生成 | 淀粉完全水解 |
C | 将少量SO2气体通过足量Na2O2 | 余下气体能使带火星木条复燃 | 有O2生成 |
D | 用pH试纸分别测定等浓度的A、B两溶液(可能为NaHCO3或者Na2CO3)的pH值 | pHA> pHB | A溶液为Na2CO3溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生下列反应:2HI![]() H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
A. 5 sB. 10 sC. 大于10 sD. 小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
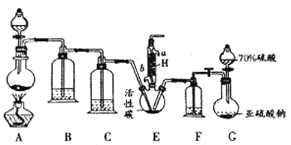
已知:①SO2(g) + Cl2(g)=SO2Cl2(l); △H=-97.3 kJ·mol-1
② 硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③硫酰氯在100℃以上或被长时间存放都易分解,生成二氧化硫和氯气
回答下列问题:
(1)硫酰氯在潮湿空气中“发烟”的原因是________________(用化学方程式表示)。
(2)检验装置G的气密性的方法是_________________________。
(3)装置A中发生反应的离子方程式为_________________________。
(4)H的作用是____________其中水流的方向是_____进________出(填“a”或“b”)
(5)装置C、F中的试剂相同,盛放的试剂为____________________。
(6)该装置存在的一处缺陷是____________________。
(7)若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应(简要描述实验步骤、现象和结论)________________仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、氯化亚铁溶液、硫氰化钾溶液、品红溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,反应速率加快是由催化剂引起的是( )
A.在炭粉中加入KClO3,点燃时燃烧更为剧烈
B.H2O2中加入少量MnO2,即可迅速放出气体
C.将炭块粉碎成粉末状,可使燃烧更加充分
D.电解水时,加少量硫酸可使电解速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com