
一定温度下,4个容器均为1L的容器中,分别进行反应:C(s)+H2O(g) 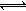 CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是
CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是 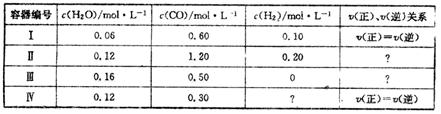
| A.在容器Ⅱ中,v(正)<v(逆) |
| B.在容器Ⅳ中,H2的浓度为0.40 mol.L-1 |
| C.在容器Ⅲ中, 反应达到平衡时吸收的热量为13.13 KJ |
| D.若将平衡时容器Ⅰ、Ⅳ中的物质混合于容积为1L的容器中,则反应仍处于平衡状态 |
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.6 0.6 |
ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正 > > ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2009?广州模拟)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
(2009?广州模拟)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 0.60 |
ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正 > > ν逆 |
查看答案和解析>>
科目:高中化学 来源:2013届河南周口重点高中四校高二下学期第一次联考化学卷(解析版) 题型:选择题
一定温度下,4个容器均为1L的容器中,分别进行反应:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是
CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是 
A.在容器Ⅱ中,v(正)<v(逆)
B.在容器Ⅳ中,H2的浓度为0.40 mol.L-1
C. 在容器Ⅲ中, 反应达到平衡时吸收的热量为13.13 KJ
D.若将平衡时容器Ⅰ、Ⅳ中的物质混合于容积为1L的容器中,则反应仍处于平衡状态
查看答案和解析>>
科目:高中化学 来源:2008-2009学年广东省广州市高三(上)调研化学试卷(解析版) 题型:解答题
| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ______ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正______ν逆 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com