
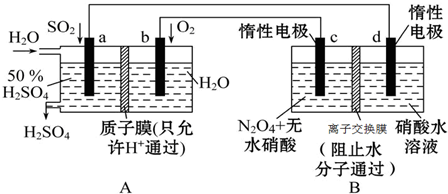
分析 (1)A装置能自发的进行氧化还原反应且没有外接电源;
(2)与电源的正极相连的电极为阳极,N2O4在阳极失电子生成N2O5;
(3)通入O2一极是原电池的正极,氧气得电子生成水;
(4)电池的负极反应式为:SO2-2e-+2H2O=4H++SO42-,根据方程式计算,注意硫酸的浓度不变.
解答 解:(1)A装置能自发的进行氧化还原反应且没有外接电源,所以是原电池,
故答案为:原电池;
(2)与电源的正极相连的电极为阳极,c极与正极相连为阳极,N2O4在阳极失电子生成N2O5,电极反应式为:N2O4+2HNO3-2e-═2N2O5+2H+;
故答案为:c极;N2O4+2HNO3-2e-═2N2O5+2H+;
(3)通入O2一极是原电池的正极,电极反应式为:O2-4e-+4H+=2H2O,故答案为:O2-4e-+4H+=2H2O;
(4)电池的负极反应式为:SO2-2e-+2H2O=4H++SO42-,1min内n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,消耗水0.2mol,生成硫酸的质量为:0.1mol×98g/mol=9.8g,消耗水的质量为:0.2mol×18g/mol=3.6g,向右侧正极区定向移动0.2mol,即0.2g H+,
设1min内通入xmLH2O,
则有:$\frac{9.8g}{9.8g+x×1g/mol-3.6g-0.2g}$×100%=50%
x=13.6mL/min,
故答案为:13.6.
点评 本题考查了原电池和电解池原理,根据是否自发进行判断原电池和电解池,再结合各个电极上发生的电极反应分析解答,难点是电极反应式的书写,题目难度中等,侧重于考查学的分析能力和计算能力.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe在少量Cl2中燃烧生成FeCl2 | |
| B. | 石油的裂解、煤的干馏都是化学变化 | |
| C. | 化学反应的焓变与反应的途径有关 | |
| D. | 等质量的铜按a、b两种途径完全转化为硝酸铜,途径a、b消耗的硝酸一样多 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2;途径b:Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 原电池阳极发生氧化反应 | |
| C. | 电解池阴极发生还原反应 | |
| D. | 电解池的阴极连接电源正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+与SO42-的物质的量浓度之比为2:3 | |
| B. | 1L溶液中SO42-的物质的量为1.5mol | |
| C. | 准确称取17.1g的Al2(SO4)3用100 mL蒸馏水溶解可配制得到该浓度的溶液 | |
| D. | 从1L 0.5 mol•L-1Al2(SO4)3溶液中取出100mL,Al3+浓度仍为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
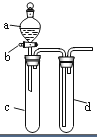 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| B. | 向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ | |
| C. | 向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>A | |
| B. | 气态氢化物的稳定性:A>B | |
| C. | 最髙价氧化物对应水化物的碱性:C<D | |
| D. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com