
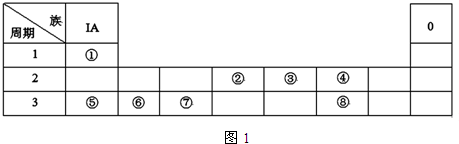
分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是S,
(1)上述元素中只有N、S的最高价氧化物的水化物为强酸,Na的金属性最强,最高价氧化物的水化物碱性最强;
(2)电子层相同的离子,核电荷数越大半径越小;
(3)离子化合物为NaHSO3、NaHSO4,二者反应生成硫酸钠、水、二氧化硫;
(4)符合同一反应中两种单质对应元素既不同周期也不同主族的置换反应,如Mg置换C、Mg置换H;
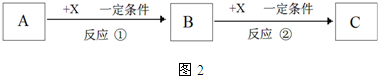
(5)A、B、C含同一金属元素,X为强电解质,由图中连续反应可知,若A为铝盐,X为NaOH;若A为偏铝酸盐,X为强酸.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是S,
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是H2SO4、HNO3;碱性最强的是NaOH,故答案为:H2SO4、HNO3;NaOH;
(2)电子层相同的离子,核电荷数越大Mg的最大,则离子半径为O2->Na+>Mg2+,故答案为:O2->Na+>Mg2+;
(3)离子化合物为NaHSO3、NaHSO4,二者反应生成硫酸钠、水、二氧化硫,离子反应为H++HSO3-=SO2+H2O,故答案为:H++HSO3-=SO2+H2O;
(4)符合同一反应中两种单质对应元素既不同周期也不同主族的置换反应,如Mg置换C、Mg置换H,反应分别为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO、Mg+H2SO4=MgSO4+H2↑,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO、Mg+H2SO4=MgSO4+H2↑;
(5)A、B、C含同一金属元素,X为强电解质,由图中连续反应可知,若A为铝盐,X为NaOH;若A为偏铝酸盐,X为强酸(如H2SO4或HNO3)则B均为Al(OH)3,
故答案为:Al(OH)3;NaOH;H2SO4或HNO3.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有自发进行的化学反应都是放热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| B. | 元素X与W形成的共价化合物有很多种 | |
| C. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、K+、MnO4-、SO42- | |
| B. | 能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 常温下c(OH-)=1×10-13mol•L-1的溶液:NH4+、Al3+、SO42-、Cl- | |
| D. | 含1.2 mol•L-1 NO3-的溶液:H+、Fe2+、Mg2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A | ||
| B | C | |
| D | E |
| A. | E的单质可与D的氢化物反应制得D的单质,所以非金属性:E>D | |
| B. | 对应的离子半径:E>D>C | |
| C. | 对应氢化物的熔沸点:B>D,因为B的氢化物分子内存在氢键 | |
| D. | B、C、D、E四种元素中,C的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN | B. | HF | C. | CH3COOH | D. | HNO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com